|
bac S Liban 2007 : de la reine des prés à l'aspirine , acide base, ester En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptés à vos centres d’intérêts. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
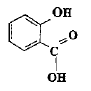
La reine des prés (Filipendula Ulmaria ou spirée) est une plante vivace des zones humides. Sa tige, haute de 50 cm à 1,50 m, est surmontée d'une grappe de fleurs, de couleur crème, au parfum doux. Les fleurs contiennent de l'acide salicylique ou acide spirique (acide 2-hydroxybenzoïque) connu pour ses propriétés inflammatoires et son action apaisante lors de douleurs articulaires. On prépare un volume V d'une solution aqueuse d'acide salicylique de concentration molaire en soluté apporté C = 1,0 10-2 mol.L-1. On mesure le pH de la solution à 25°C : pH = 2,5. Aide au calcul : log (2,5) = 0,4 ; log (1,3) = 0,1 ;§ 102,5 = 3 x 102 ; 10-2,5 = 3 10-3 ; 9/7 = 1,3 voisin de 1.
Définition d'un acide au sens de Brönsted. Espèce, ion ou molécule susceptible de céder un proton H+. Equation chimique de la réaction de l'acide salicylique avec l'eau en utilisant les formules semi développées.
Taux d'avancement final t de cette réaction : t = xf / xmax avec xmax = CV et xf = [H3O+]f V = 10-pH V. t =10-pH / C =10-2,5 / 10-2 = 3 10-3 / 10-2 ; t = 0,3. Le taux d'avancement final étant inférieur à 1, la transformation n'est pas totale. Quotient de réaction à l'équilibre Qr,éq de cette réaction : Qr,éq = [H3O+]éq [A-]éq / [AH]éq . La solution est électriquement neutre : [ H3O+]éq = [A-]éq = 10-2,5 = 3 10-3 mol/L Conservation de A : [AH]éq + [A-]éq = c = 1,0 10-2 mol/L [AH]éq = c - [A-]éq =1,0 10-2 - 3 10-3 = 7 10-3 mol/L Par suite Qr,éq = 3 10-3*3 10-3 / 7 10-3 = 9/7 10-3 voisin de 10-3. Ce quotient de réaction à l'équilibre est la constante d'acidité Ka du couple acide/base ; cette constante Ka ne dépend que de la température ( elle ne dépend pas des conditions initiales). Equation chimique de la réaction entre la solution d'acide salicylique, noté HA(aq), et la solution d'hydroxyde de sodium : AH(aq) + HO-(aq) = H2O +A-(aq).
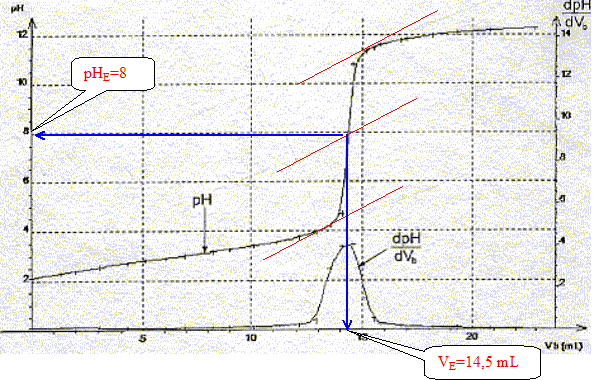
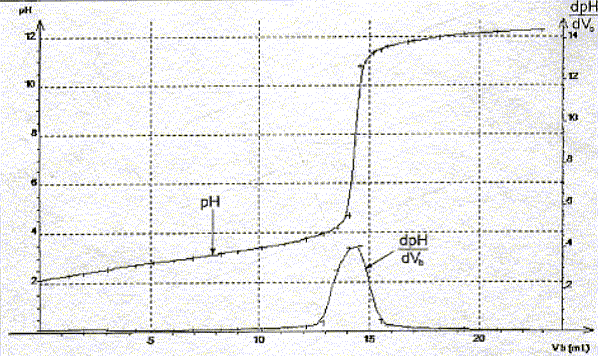
A l'équivalence les quantités de matière des réactifs mis en présence sont en proportions stoechiométriques. Concentration molaire en acide salicylique de la solution diluée puis de la solution pharmaceutique : c vA= cb VE soit c = cb VE / vA=0,10*14,5 / 20 = 7,2 10-2 mol/L La solution pharmaceuthique est 10 fois plus concentrée soit : 7,2 10-1 mol/L. Choix d'un indicateur coloré : La zone de virage de l'indicateur coloré doit contenir le pH du point équivalent ( pH= 8 dans ce cas): donc le rouge de crésol est le plus approprié.
En 1853, le français Charles-Frédéric Gerhardt réalisa l'acétylation de l'acide salicylique en créant l'acide acétylsalicylique plus connu sous le nom commercial aspirine, mais ses travaux tombèrent dans l'oubli. Commercialisée en 1899 par les laboratoires allemands Bayer, à la suite de la découverte par l'allemand Félix Hoffman des propriétés du composé, l'aspirine a depuis de nombreuses indications. Environ 40 000 tonnes de comprimés, achets, gélules, suppositoires sont consommés chaque année.
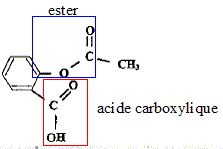
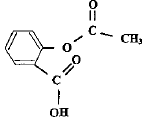
Equation chimique de la réaction de synthèse de l'acide salicylique à partir de l'acide salicylique et de l'acide éthanoïque :
Les ions oxonium jouent le rôle de catalyseur. Un catalyseur accélère une réaction chimique naturellemnt lente ; il n'apparaît pas dans le bilan de la réaction. ( il est régénéré en fin de réaction) En utilisant un réactif en excès, on déplace l'équilibre vers la droite, formation de l'ester : le rendement est amélioré. Cette synthèse peut être réalisée de façon plus efficace en remplaçant l'acide carboxylique par l'un de ses dérivés, chlorure d'éthanoyle ou anhydride éthanoïque. Dans ce cas la réaction est totale.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
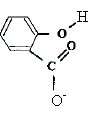 (aq)
(aq)