|
Stockage d'énergie ( concours Centrale 02 ; X 04 ) aluminium : source d'énergie ; magnésium utilisé comme combustible ( chauffe plat chimique) En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts. |
|||||||||||
| .
. |
|||||||||||
|
|||||||||||
|
|
Données à 298 K : enthalpie standard de formation de H2O(l): -285,8 kJ/mol ; de l’oxyde d’aluminium Al2O3(s) :-1676 kJ/mol ; masse molaireM(Al )= 27 g/mol L’aluminium réagit sur l’eau en donnant un dégagement de dihydrogène et de l’oxyde d’aluminium.
corrigé Al (s) +1,5 H2O(l) = ½Al2O3 (s) +1,5 H2 (g) Chaleur produite = variation d'enthalpie de la réaction = DrH DrH = ½DfH (Al2O3) + 1,5 DfH (H2) - DfH (Al)-1,5DfH (H2O) Les enthalphies de formation des corps simples sont nulles d'où : DrH = ½DfH (Al2O3) -1,5DfH (H2O) DrH =0,5*(-1676)-1,5*(-285,8) = -838+428,7 = -409,3 kJ/mol Quantité de matière dans 1000g d'aluminium (mol) = masse (g) / masse molaire (g/mol) = 1000/27 = 37,0 mol Quantité de chaleur produite par 1 kg d'Al réagissant sur l'eau : 37*(-409,3)= -1,52 104 kJ/kg. pouvoir énergétique massique de l'aluminium / pouvoir calorifique des carburants = 1,52 104 / 4,2, 104 voisin 0,3. Ajoutons que le dihydrogène formé est également un combustible ; par contre l'aluminium est un métal couteux à produire.
|
||||||||||
|
Le magnésium constitue le combustible d’un chauffe-plat chimique breveté aux U.S.A en 1981 et représenté sur la figureci-dessous : 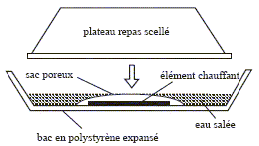 L’élément chauffant est constitué par une fine grenaille de magnésium (incorporant 5% de fer) dispersée parmi des billes de polyéthylène haute densité ; le tout est placé dans un sachet poreux fixé au fond d’un bac sur lequel vient s’adapter le plateau repas à chauffer. La mise en marche s’opère par addition d’eau salée dans le bac. On réchauffe le plateau-repas en moins de 15 minutes. L’ajout d’eau salée au solide contenu dans le sac poreux se traduit par une forte effervescence s’accompagnant rapidement d’un échauffement notable et d’un dégagement de vapeur. On peut vérifier que les bulles de gaz qui se dégagent sont inflammables. Quand l’opération est terminée on constate que la grenaille métallique a disparu et qu’elle fait place à une bouillie blanche (hydroxyde de magnésium) dispersée sur les billes de polyéthylène.
corrigé Mg (s)+2 H2O(l) = Mg(OH)2 (s) + H2(g) DrH = DfH (Mg(OH)2 ) + DfH (H2) - DfH (Mg)-2DfH (H2O) Les enthalphies de formation des corps simples sont nulles d'où : DrH = DfH (Mg(OH)2 ) -2DfH (H2O) DrH = -924-2(-286) = -352 kJ/mol Na(s) + H2O(l) = Na+(aq) +HO–(aq) +½ H2(g) DrH = DfH (Na+ ) + fH (HO– ) + ½DfH (H2) - DfH (Na)-DfH (H2O) Les enthalphies de formation des corps simples sont nulles d'où : DrH =DfH (Na+ ) + fH (HO– ) -DfH (H2O) DrH =-240-230-(-286)= -184 kJ/mol. La réaction du magnésium sur l'eau est la plus exothermique par mole de métal. Mais elle met en jeu deux moles d'électrons par mole de métal ( 352/2 = 156 kJ/mol d'électrons. C'est le contraire par mole d'électrons mis en jeu. La réaction du sodium avec l'eau étant violente, ce dernier n'est pas utilisé.
|
|||||||||||
|
|