|
|
oxydo réduction En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
||||||||||||||||||||||||||||||||||||
| .
. |
|||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||
|
|
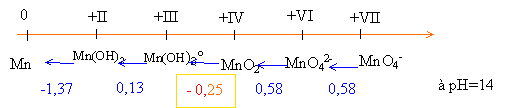
Manganèse |
Porter sur un axe les espèces par ordre croissant des nombres d'oxydation.
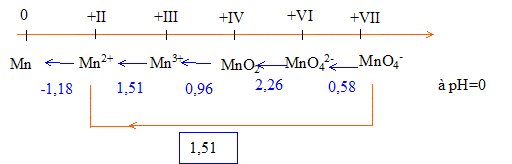
Calcul du potentiel du couple redox MnO4- / Mn2+ à partir des valeurs ci-dessus : MnO4- +8H++5e-=Mn2++4H2O : 5 électrons sont mis en jeu.
Faire la somme : S ni Ei = 0,58 + 4,52 +0,96+1,51 = 7,57 Diviser par 5 d'où : E(MnO4- / Mn2+) = 1,51 V
2Mn(OH)3 = MnO2 + Mn(OH)2 +2H2O : dismutation de Mn(OH)3
|
|||||||||||||||||||||||||||||||||||
|
Iode |
On considère le diagramme de Latimer suivant pour les différentes formes oxydées de l'élément iode en milieu acide (pH = 0) et pour des concentrations molaires des espèces. IO4- <--1,69 V--- IO3- <--1,14 V--- IO- <--1,45 V--- I2(aq) <--0,54 V--- I-
corrigé 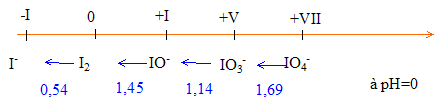
Il y a dismutation d'une espèce si celle-ci est situé à droite d'une autre espèce, avec un potentiel inférieur. IO- se dismute suivant : 4 IO- +8 H+ + 4e- = 2 I2(aq) + 4 H2O : IO- se réduit IO- + 2H2O = IO3- + 4e- + 4 H+ : IO- s'oxyde d'où : 5 IO- + 4 H+ = IO3- + 2 I2(aq) + 2 H2O Les autres espèces sont stables. Calcul du potentiel du couple redox IO3- / I2(aq) à partir des valeurs ci-dessus :
IO3- + 5e- + 6H+= ½ I2(aq) + 3H2O ( 5 électrons mis en jeu) Diviser par 5 d'où : E(IO3- / I2(aq)) = 6,01 / 5 = 1,2 V. |
||||||||||||||||||||||||||||||||||||
|
|
|
||||||||||||||||||||||||||||||||||||