|
absorption, oxydation de l'éthanol dans le sang cinétique chimique En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| .
. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
On note V1 : volume (L) d'alcool absorbé se retrouvant dans l'estomac et dans l'intestin ; V2 = 32 L : volume du sang et autres liquides de l'organisme. 1ère étape : un homme boit V1 = 0,20 L de vin contenant n= 0,8 mol d'éthanol ; ce dernier passe à travers la paroi de l'estomac et de l'intestin pour se retrouver dans le sang. On note en fonction du temps la concentration c1(t) de l'éthanol dans le système estomac-intestin, concentration supposée uniforme.
étape n°2 : oxydation de l'éthanol dans le sang. On injecte directement dans le sang une quantité n (mol) d'éthanol et on détermine la concentration de l'alcool non oxydé en fonction du temps.
étape n°3 : l'automobiliste boit de l'alcool : il ne peut conduire que si la teneur en alcool dans le sang est inférieure à 0,5 g/L soit 1,1 10-2 mol/L On suppose que les lois de vitesse précédentes restent valables. Un conducteur absorbe V1 = 0,5 L de vin contenant n = 1 mol d'éthanol. ( date initiale)
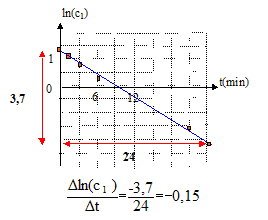
Le graphe est une droite de pente -0,15 : la cinétique est donc d'ordre 1, de constante de vitesse k1 = 0,15 min-1 -dc1/dt = k1 c1 Séparer les variables puis intégrer : dc1/ c1 = -k1 dt ; ln c1 = -k1 t + Cte La constante est déterminée par les conditions initiales c1(0) = 4 mol/L = c0 ; ln c0 = Cte d'où : ln c1 = -k1 t + ln c0 ; c1 = c0 exp(-k1 t ) = 4 exp(-0,15 t ) La quantité de matière (mol) d'éthanol est constante : c1 V1 + c2 V2 = constante ( c2 concentration de l'alcool supposée uniforme dans le sang et autres liquides de l'organisme) Dériver par rapport au temps : V1 dc1/dt + V2dc2/dt = 0 d'où : v2 = dc2/dt = -V1 /V2dc1/dt vitesse d'oxydation de l'éthanol dans le sang ( disparition de l'alcool) : - dc2/dt.
avec k2 = 3,5 10-3mol L-1 h-1 = 5,8 10-5 mol L-1 min-1 et l'ordre de la réaction est nul. D'une part l'éthanol pénètre dans le sang en traversant la paroi de l'intestin ( vitesse : -V1 /V2dc1/dt ) ; d'autre part l'éthanol disparaît par oxydation ( vitesse : -k2) Ajouter ces deux vitesses : dc2/dt = -V1 /V2dc1/dt -k2 avec c1 = c0 exp(-k1 t ) d'où dc1/dt = -c0k1exp(-k1 t ) dc2/dt = V1c0k1 /V2exp(-k1 t ) -k2 avec V1c0 = n = 1 mol ; dc2/dt = k1 /V2exp(-k1 t ) -k2 (dc2/dt) t=0 = k1 /V2-k2 = 0,15/32 - 5,8 10-5 = 4,6 10-3 mol L-1 min-1 . en réalité (dc2/dt) t=0 =0, l'alcool est oxydé dès qu'il arrive dans le sang et la concentration initiale de l'éthanol dans le sang est nulle. Intégrer la loi de vitesse après séparation des variables : dc2/dt =k1 /V2exp(-k1 t ) -k2 c2 = -1/V2exp(-k1 t )-k2 t + cte à t=0, c2=0 d'où la valeur de la constante d'intégration : cte = 1/V2 c2 = 1/V2(1-exp(-k1 t ))-k2 t. Recherche de la concentration maximale d'éthanol dans le sang : dc2/dt = k1 /V2exp(-k1 t ) -k2 s'annule. k1 /V2exp(-k1 t ) = k2 ; exp(-k1 t ) = k2V2 / k1 ; -k1 t = ln (k2V2 / k1 ) ; t = -1/k1 ln (k2V2 / k1 ) t = - 1/0,15 ln(5,8 10-5*32/0,15)=29,3 min. Repport dans l'expression de c2 : c2 m = 1/32(1- exp(-0,15*29,3))-5,8 10-5*29,3 = 0,029 mol/L. L'automobiliste peut repartir si c2 est inférieure ou égale à 1,1 10-2 mol/L: 1,1 10-2 =1/V2(1-exp(-k1 t ))-k2 t 1,1 10-2 =1/32(1-exp(-0,15 t ))-5,8 10-5 t or la cinétique d'oxydation de l'éthanol est bien plus lente que la cinétique de passage de l'éthanol dans le sang : à t supérieur à 60 min le terme exp(-0,15 t )) est négligeable devant 1 par suite 1,1 10-2 =1/32-5,8 10-5 t ; 5,8 10-5 t =0,02 ; t = 349 min = 5, 8 h = 5 h 48 min. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|