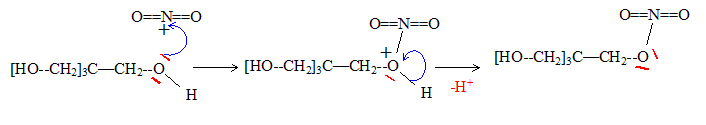corrigé
Combustion d'hydrocarbures
:
Equation de la réaction de combustion complète d'un hydrocarbure de
formule CxHy dans le
dioxygène :
CxHy +
(x+0,25 y)O2 = x CO2 + ½y
H2O
Les atomes d'azote contenus dans une molécule organique à l'issue de la
combustion de celle-ci se retrouvent sous forme de N2
ou d'oxydes d'azote suivant l'excès de dioxygène.
Condition entre x, y et z pour qu'un explosif soit
"suroxygéné" :
Le dioxygène se trouve en proprotions stoechiométriques
si le nombre z d'atomes d'oxygène est égal à : z =2( x+0,25y)
Il y a excès de dioxygène si z > 2x+½y
Un excès d'oxygène :
- Oxyde N2 et N2
O en NOx : la quantité de NOx
augmente
- Oxyde CO en CO2 : la quantité de CO formé
diminue.
Mélange oxydant réducteur
:
oxydant : espèce susceptible de gagner un
(des) électron(s) dans une réaction de réduction : Ox1
+ n1 e- = red1.
réducteur : espèce susceptible de
céder un (des) électron(s) dans une réaction d'oxydation : red2
= Ox2 + n2 e-
Un complexe métal-ammine tel que Cu(NH3)42+
peut être interprété comme une espèce où coexistent un oxydant et un
réducteur :
L'ion cuivre II peut être réduit en cuivre métal : Cu2+
+ 2e- = Cu(s)
l'ammoniac peut être oxydée en N2
: 2 NH3 = N2 + 6H+
+ 6e-.
Equation de décomposition du nitrite d'ammonium
: NH4NO2(s) = N2
+ 2H2O
Synthèse de la pentrite
:
La pentrite C5H8N4O12
est sous oxygénée : z = 12 ; 2x+½y = 14 ; z < 2x+½y.
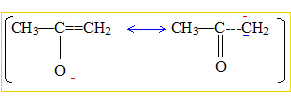
Les atomes d'hydrogène du groupe CH3
du méthanal possèdent des propriétés acide :
L'arrachement par une base d'un hydrogène en position a du groupe carbonyle
>C=O, donne un anion très stabilisé : en conséquence cet
hydrogène est acide.
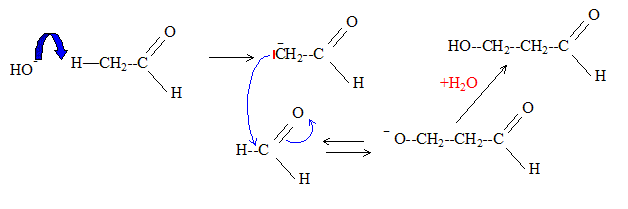
Formule semi-développée du produit de formule brute C3H6O2
obtenu par réaction de l'éthanol sur le méthanal en milieu basique :
HO-CH2-CH2-CHO
Cette réaction s'appelle aldolisation. Son mécanisme :
Formule semi-développée du produit de formule brute C5H10O4,
noté A, obtenu par réaction entre un équivalent d'éthanal et de trois
équivalents de méthanal en milieu basique : [HO-CH2]3C--CHO
Catégorie de réactions à laquelle appartient
la transformation représentée par l'équation (1) : oxydo-réduction
A + HCHO + H2O= C(CH2OH)4+HCOOH
(1).
oxydation : HCHO + H2O
= HCOOH + 2H+ + 2e-.
réduction de la fonction aldehyde de A en alcool : [HO-CH2]3C--CHO+
2H+ + 2e- = [HO-CH2]4C
Passage à la pentrite
:
Equation de la réaction d'autoprotolyse de l'acide nitrique :
2HNO3 = H2NO3+
+ NO3-
Cation obtenu lorsque l'acide conjugué de l'acide nitrique perd une
molécule d'eau : NO2+
nitronium
Le pentaérythrytol C(CH2OH)4
traité par l'acide nitrique fumant, conduit à la pentrite : le
mécanisme réactionnel pour cette transformation.
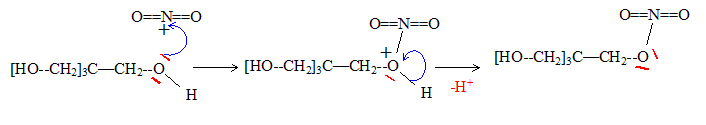
Explosion de la pentrite
:
Lors de son explosion la pentrite se décompose de façon totale :
Pentrite (s) = 2N2(g) + 4H2O(g)
+ 3CO2(g) + 2CO(g) (2)
Dans un réacteur de volume fixe V=1,0 L, initialement vide, on
introduit m=100 g de pentrite à Tini = 300 K.
Par un raisonnement sur l'énergie interne de la réaction (2), on peut
calculer que la température atteinte par le mélange à l'issue de la
réaction (2) conduite dans des conditions adiabatiques est Texp=
4600 K.
Calcul de la pression d'explosion Pexp
dans le réacteur à l'issue de la réaction (2) à la température Texp:
M(pentrite) =316 g/mol ; n(pentrite = m/M=100/316 =
0,3154 mol
n(gaz) = 11 * n(pentrite) =3,48 mol
Pexp = nRTexp/V=3,48*8,31*4600
/ 10-3 = 1,33 108 Pa =
1,33 103 bar.
Texp = 4600 K : le récipient ne peut ni rester
sous forme solide ou liquide à 4600 K.
Pexp=1,33 103
bar : le récipient ne peut pas supporter de telles pressions.