|
physique chimie : le Magnésium En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts. |
|||||||||||||||
| .
. |
|||||||||||||||
|
|||||||||||||||
|
|
Afin d'alléger les écritures, la notation "aq" relative aux ions en solution n'a pas été indiquée.
corrigé Règles permettant d'établir la structure électronique d'un atome polyélectronique : Règle de Pauli : deux électrons se différencient par au moins l'un de leur nombres quantiques n, l, m et s. Règle de Klechkowski : l'ordre de remplissage des orbitales se fait suivant (n+l) croissant ; si deux orbitales atomiques ont le même nombre (l+n), celle qui a la plus faible valeur de n est remplie en premier ( principe de stabilité) 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f... Règle de Hund : cas des orbitales de mêmes énergie. Les électrons de spins parallèles occupent le maximum d'orbitales. Configuration électronique du magnésium dans l'état fondamental :1s2 2s2 2p6 3s2. Forme ionique du magnésium : Mg2+ ; structure électronique 1s2 2s2 2p6 ( couche externe saturée à 8 électrons ) Au cours des réactions chimiques, le magnésium tend à obtenir la structure électronique externe du gaz noble le plus proche. Colonne de la classification périodique se trouve le magnésium : colonne n°2 des alcalino-terreux Chaque élément de cette colonne possède une structure électronique avec deux électrons externes. L'élément précédent le magnésium dans cette colonne est le bérylium de n° atomique 12-8 = 4 ; le suivant est le calcium de n° atomique 12+8 = 20. Energie de première ionisation : L'énergie de première ionisation est l'opposée de l'énergie orbitalaire de l'electron arraché ; c'est l'énergie qu'il faut fournir à l'atome, pris dans son état fondamental, pour arracher un électron externe. L'énergie de première ionisation diminue au sein d'une même famille quand n croît ; l'énergie de première ionisation diminue en descendant un groupe : les orbitales électroniques s'expandent de plus en plus lorsque le nombre quantique principal n augmente. Les électrons de valence occupent une région de l'espace de plus en plus lointaine du noyau et seront donc plus faciles à arracher à l'élément. Position des éléments en descendant la colonne : Be, Mg, Ca, Sr, Ba |
||||||||||||||
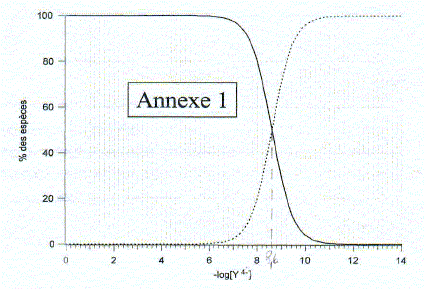
corrigé Domaine de prédominance des différentes formes de H4Y en fonction du pH
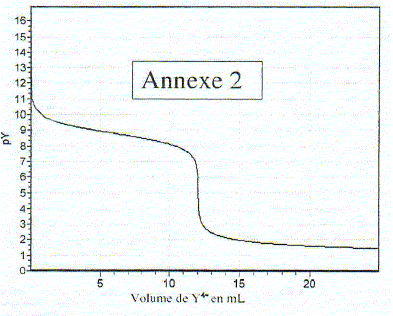
Equation de la réaction de formation de MgY2- : Mg2+ + Y4- = MgY2- Expression de la constante de formation du complexe que l'on notera bMg : bMg = [MgY2-] /([Mg2+][Y4-]) Identifier les deux espèces sur le graphe : log bMg = log ([MgY2-] /[Mg2+]) - log [Y4-]) = log ([MgY2-] /[Mg2+]) +pY log ([MgY2-] /[Mg2+]) = log bMg -pY = 8,6 -pY si pY<8,6 ( partie gauche du graphe annexe 1) alors log ([MgY2-] /[Mg2+])>0 et [MgY2-]>[Mg2+] si pY>8,6 ( partie droite du graphe annexe 1) alors log ([MgY2-] /[Mg2+])<0 et [MgY2-]<[Mg2+] Déterminer graphiquement bMg : à l'intersection des deux courbes [MgY2-] =([Mg2+] ; l'abscisse de l'intersection donne pY= 8,6 en conséquence bMg = 1 /[Y4-] : log bMg = - log [Y4-] = pY = 8,6 bMg = 108,6 = 3,98 108. Points remarquables de la courbe : valeurs déduites. La brusque variation de pY correspond à l'équivalence :VE= 12 mL A la demi équivalence ( V= 6 mL Y4- ajouté ), MgY2-] =([Mg2+] : l'ordonnée de ce point permet de retrouver log bMg . Dosage d' une eau minérale : Mg2+ : 7,5 mg/L ; M(Mg) = 24,3 g/mol d'où [Mg2+]= 7,5/ 24,3 = 0,309 mmol/L Ca2+ : 63,2 mg/L ; M(Ca) = 40,1 g/mol d'où [Ca2+]= 63,2/40,1 = 1,58 mmol/L C = [Mg2+] + [Ca2+] = 1,88 mmol/L = 1,88 10-3 mol/L A l'équivalence de ce dosage les quantités de matière des réactifs mis en présence sont en proportions stoechiomètriques : 50 *1,88 10-3 = 1,00 10-2 VE doù : VE = 5*1,88 = 9,4 mL.
|
|||||||||||||||
|
|
|||||||||||||||
|
Lors d'une séance de TP, on désire déterminer de façon indirecte l'enthalpie standart DrH° de la réaction de formation de l'oxyde de magnésium MgO à 298 K. Mg(s) + ½O2(g) =MgO(s) On utilise les réactions associées aux équations chimiques suivantes : Mg(s) + 2H+ = Mg2+ + H2(g) (1) DrH°1. MgO(s) + 2H+ = Mg2+ + H2O (2) DrH°2. H2(g) + ½O2(g) = H2O (3) DrH°3 = -285 kJ/mol Mode opératoire : - Préparation du calorimètre : on pèse un becher en verre mv=63,69 g ; on introduit dans le becher me = 125,00 g de solution d'acide chlorhydrique à 1,00 mol/L ; on place ensuite le becher préparé précédemment dans un calorimètre et on mesure la température initiale du système qi=19,4°C. - Expérience 1 : dans le becher précédent on introduit m1 = 0,51 g de tournure de magnésium Mg(s) ; on ferme le calorimètre, on agite puis on relève la température finale du système : qf 1=35,2°C. - Expérience 2 : dans un becher préparé de la même manière on introduit m2 = 1,00 g de magnésie MgO(s) ; on ferme le calorimètre, on agite puis on relève la température finale du système : qf 2=23,2°C. Données : on néglige la capacité thermique du calorimètre. - Chaleur massique de l'eau : ce = 4,185 J g-1 K-1 ; chaleur massique du verre : cv = 0,85 J g-1 K-1 ; M( Mg ) = 24,31 g/mol ; M(O) = 16,00 g/mol ; masse volumique de l'eau r= 1,00 103 kg m-3.
corrigé Précision de la balance utilisée pour mesurer les masses de magnésium et de magnésie, masses exprimées avec deux décimales : donc balance életronique au centième de gramme. Précision du thermomètre : températures exprimées avec une décimale, donc thermomètre au dixième de degré. Le rôle du calorimètre : enceinte adiabatique, limitant considérablement les échanges thermiques avec le milieu extérieur. ( dans notre cas la différence de températures entre l'extérieur et l'intérieur du calorimètre est faible, et l'expérience est de courte durée : les échanges thermiques sont quasiment nuls ) La température finale est repérée en utilisant un thermomètre électronique donc la sonde de mesure passe à travers le couvercle du calorimètre et plonge dans le becher. Approximations faîtes sur la chaleur massique et sur la masse volumique de la solution d'acide chlorhydrique : on assimile la chaleur massique et la masse volumique de la solution d'acide chlorhydrique à celles de l'eau, l'acide étant moyennement concentré. Catégorie de réactions : réaction ( 1) : oxydo-réduction ; (2) acide base Réaction (1) : Mg(s) est le réducteur, H+ est l'oxydant. Réaction (2) : couples acide base : Mg2+/ MgO(s) et H3O+ / H2O. Réactif en défaut pour la transformation (1) : Mg(s) + 2H+ = Mg2+ + H2(g) n0(Mg) = m/M= 0,51/24,31 = 2,1 10-2 mol ; n0(H+) = CV = 1*0,125 = 0,125 mol D'après les coefficients stoechiomètriques, 2,1 10-2 mol de magnésium nécessite 4,2 10-2 mol mol d'ion H+. Or on a mis 0,125 mol d'acide : donc l'acide est en exès et le magnésium en défaut. Réactif en défaut pour la transformation (2) : MgO(s) + 2H+ = Mg2+ + H2O n0(MgO) = m/M= 1/(24,31+16) = 2,5 10-2 mol ; n0(H+) = CV = 1*0,125 = 0,125 mol D'après les
coefficients stoechiomètriques, 2,5 10-2 mol de
MgO nécessite 5 10-2 mol mol d'ion H+.
Or on a mis 0,125 mol d'acide : donc l'acide est en exès et l'oxyde de
magnésium en défaut. énergie gagnée par les corps froids : DrH°1=(mvcv+mece)(qf 1-qi)=(63,69*0,85+125*4,185) (35,2-19,4)=9,12 103 J à partir de 0,51 g Mg d'où par mol de magnésium : 9,12 103 *24,1/0,51 = 4,35 105 J/mol = 4,35 102 kJ/mol La transformation chimique (1) est donc exothermique : DrH°1 = - 4,35 102 kJ/mol. La transformation (2) étant totale, en déduire DrH°2 : DrH°2= énergie gagnée par les corps froids DrH°2=(mvcv+mece)(qf 2-qi)=(63,69*0,85+125*4,185) (23,2-19,4)=2,19 103 J à partir de1 g MgO d'où par mol de MgO : 2,19 103 *40,31 = 8,83 104 J/mol = 88,3 kJ/mol La transformation chimique (2) est donc exothermique : DrH°2 = - 88,3 kJ/mol. Valeur de DrH°, enthalpie standard de formation de MgO(s) : (1) + (3)-(2) donne Mg(s) + ½O2(g) =MgO(s) d'où : DrH° = DrH°1 + DrH°3 -DrH°2= - 435+ (-285) -(-88,3 )= - 632 kJ /mol.
|
|||||||||||||||
corrigé Formes de Kékulé du benzène 
Règle permettant de savoir si un composé organique cyclique possède les mêmes propriétés que le benzène : Un polyène monocyclique et plan constitue un système aromatique lorsque le nombre d'électrons p est égal à 4n+2, n étant entier. Quelles précautions faut-il prendre pour manipuler le benzène et pourquoi ? liquide inflammable et toxique ( cancèrogène pour l'homme) Port de blouse, gants, lunette de potection, travail sous hotte aspirante, en absence de toute flamme. Nature des réactions subies facilement par le benzène : substitution électrophile d'un hydrogène du benzène Equation de la réaction permettant l'obtention du bromobenzène, composé A, à partir du benzène : C6H6 + Br2 = C6H5Br + HBr (catalyseur AlBr3 anhydre). Pour obtenir à partir
de l'acide benzoïque le benzoate d'éthyle C6H5-COO-C2H5,
composé B, on réalise une estérification en présence d'alcool éthylique
CH3-CH2-OH. On utilise un
dispositif de chauffage à reflux, le catalyseur étant les ions oxonium. En remplaçant l'acide
benzoïque par l'anhydride benzoïque la réaction est, par contre totale.
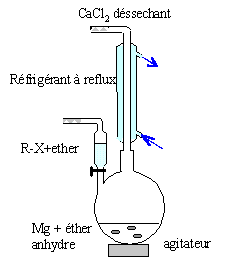
colonne Vigeux ou réfrigérant droit surmonté d'un
dispositif déshydratant contenant CaCl2. ampoule de coulée ; ajout goutte à goutte du
dérivé bromé ballon bicol contenant de l'éther anhydre et les
copeaux de magnésium Dispositif d'agitation Réactions indésirable : réaction de couplage de Wurtz RBr + RMgBr = R-R + MgBr2. On l'évite en
ajoutant goutte à goutte le dérivé bromé et en utilisant le magnésium
en excès.
La réaction se termine par une hydrolyse en milieu acide. Le composé D obtenu après hydrolyse est un alcool tertiaire : F3C-OH, triphénylméthanol On hydrolyse en milieu acide : Les magnésiens étant
des bases fortes, l'hydrolyse forme Mg(OH)2 (s),
solide blanc. On évite la formation de l'hydroxyde de magésium en
hydrolysant en milieu acide ( solution de NH4Cl
ou acide sulfurique dilué).
On achève la synthèse en séchant la phase organique en utilisant un déshydratantt : MgSO4 anhydre, Na2SO4 anhydre. Principe de l'évaporateur rotatif : distillation rapide d'un solvant Distillation sous
vide partiel. On chauffe modérément la solution puis on fait décroître
progressivement la pression jusqu'à ce que le solvant distille.
Plaque métallique chauffée par un dispositif électrique ; d'une extrémité à l'autre de la plaque s'établit un gradient de température. On étalonne cette plaque avec un ou deux échantillons dont on connaît parfaitement la température de fusion. On dépose quelques
cristaux du produit ( dont on désire connaître la température de fusion
) sur la partie la plus froide de la plaque, puis on déplace ces
cristaux vers la parite chaude, jusqu' à fusion de ces derniers.
Mis en présence d'acide sulfurique concentré le composé D donne une solution rouge : on déshydrate l'alcool tertiaire et le carbocation triphénylméthyle F3C+, stabilisé par résonnance, se forme. Un système conjugué de grandes dimensions absorbe la lumière dans le domaine visible : effet bathochrome ou déplacement du maximum d'absorbance vers les grande longueurs d'onde. D'où la couleur rouge observée, complémentaire de la couleur absorbée.
|
|||||||||||||||
|
|
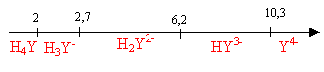



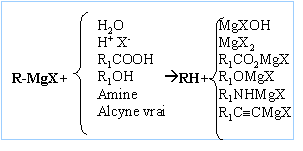
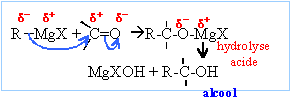
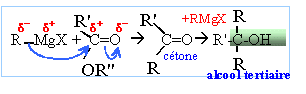 avec
R=R' = C6H5 noté F.
avec
R=R' = C6H5 noté F.