|
CAPES physique chimie ( d'après concours interne 2002 ) Conductimétrie : précipation et suivi cinétique En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts. |
||||
| .
. |
||||
|
||||
|
|
Réaction de précipitation :
Réaction de saponification : Suivi conductimétrique de la cinétique d'une réaction de saponification entre l'éthanoate d'éthyle et l'hydroxyde de sodium.
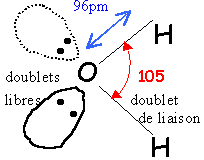
formule de Lewis de la molécule d'eau géométrie selon la méthode VSEPR :
origine de la polarisation des liaisons chimique dans la molécule d'eau :
Les principales interactions entre les molécules d'eau : liaisons hydrogène dans le liquide et le solide De nature
électrostatique, cette liaison s'établit entre un atome d'hydrogène
porteur d'une charge partielle d+
et l'atome d'oxygène d'une molécule d'eau voisine. Energie de cette
liaison : 20 kJmol-1, trés
inférieure à l'énergie d'une liaison de covalence (100 à 400).
Le plexiglas est un isolant électrique : par frottement, il porte des charges électriques localisées ; de plus les molécules d'eau sont polaires : en conséquence des forces électrostatiques de Coulomb provoquent la déviation du mince filet d'eau. Conductivité de l'eau pure : un petit nombre de molécules d'eau sont dissociées en ion oxonium H3O+ et hydroxyde HO- ; à 25°C, [H3O+]=[HO- ]= 10-7 mol/L = 10-4 mol m-3. conductivité g0 de l'eau pure : lH3O+ [H3O+] + lHO- [HO- ] = (3,498 10-2+ 1,986 10-2 ) 10-4 = 5,48 10-6 S m-1 ; L'eau ultra pure et ne contient pas (ou alors à des concentrations très faibles) de sels, de composés organiques, de gaz dissouts. La mesure effectuée sur une eau fraichement distilée donne : g = 4,2 10-4 S m-1. L'eau distillée fraîche a tendance à capturer le dioxyde de carbone atmosphérique et a un pH proche de 5. celle-ci doit donc contenir d'autres ions, en
particulier l'ion hydrocarbonate HCO3-
résultant de la dissolution du dioxyde de carbone de l'air.
L'acide chlorhydrique est un électrolyte fort ( pKa=0)
et l'acide éthanoïque un électrolyte faible ( pKa
= 4,8).
On met en solution un composé peu soluble, le chlorure
d'argent.( pKs = 9,75) On obtient une solution
saturée en chlorure d'argent dont la conductivité est égale à g =1,84 10-4
S m-1. lAg+
= 6,19 10-3 S m2 mol-1
; lCl-
= 7,63 10-3 S m2 mol-1
; lNa+
= 5,01 10-3 S m2 mol-1
; lNO3-
= 7,14 10-3 S m2 mol-1
. AgCl(s) = Ag+ (aq) + Cl-(aq) ; Ks= [Ag+][Cl-]= s² La mesure de la conductivité permet de déterminer la solubilité s du chlorure d'argent dans l'eau et de vérifier la valeur de pKs : g - g0 = lAg+ [Ag+] + lCl- [Cl-] = s(lAg++ lCl-) ; s = g / (lAg++ lCl-) =(1,84 10-4 - 5,48 10-6 ) / ((6,19+7,63)10-3) =1,29 10-2 mol m-3 = 1,29 10-5 mol/L. Ks = s² =1,67 10-10
; pKs = 9,78. Ks= [Ag+][Cl-] = (s'+c) s' proche de cs' avec c= 2,0 10-1 mol/L s' = Ks/ c = 10-9,75 / 0,2 = 8,9 10-10 mol/L. La solubilité a été divisée par 15000 : effet d'ion
commun.
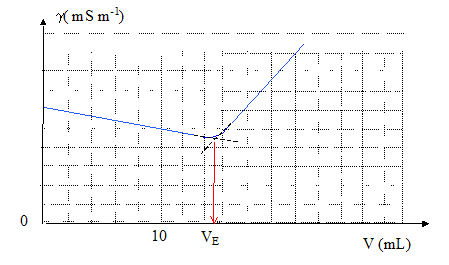
On prélève le volume v0= 10,0 mL de sérum que l'on place dans un bécher et on verse une solution de nitrate d'argent de concentration c= 1,00 10-1 mol/L contenue dans une burette.
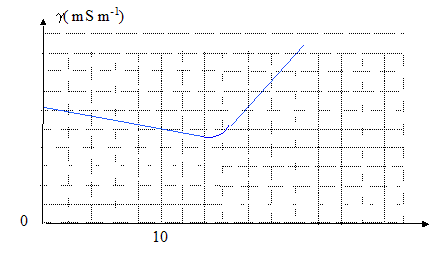
Equation de la réaction en faisant aparaître tous les ions présents : Na++ Cl- + Ag+ + NO3- = AgCl(s) + Na++ Cl- Interprétation de l'allure de la courbe : avant l'équivalence, Ag+ est en défaut : du point de vue de la conductivité, tout revient à remplacer l'ion Cl- par l'ion NO3- ; or lNO3- est un peu inférieur à lCl- et il faut prendre en compte la faible dilution : donc la conductivité diminue un peu. après l'équivalence, on ajoute des ions nitrate et
argent : la conductivité augmente rapidement. c véq = v0c0 soit c0 = c véq / v0= 0,1*15/10 = 1,50 10-1 mol/L. Comparaison avec le dosage par la méthode de Mohr. L'indicateur de fin de réaction est l'ion chromate CrO42-.
Ces derniers peuvent réagir avec les ions argent pour donner un
précipité de chromate d'argent de couleur rouge. Comme précédemment on
prélève le volume v0 = 10,0 mL de sérum que l'on
place dans un erlenmeyer et on ajoute 50 mL d'eau distillée ainsi que 5
gouttes de chromate de potassium à c'=2,0 10-1
mol/L. On verse la solution de nitrate d'argent de concentration c=
1,00 10-1 mol/L contenue dans la burette. On
observe la coloration rouge pour le volume versé v'éq
= 15,1 mL Cl- + Ag+ = AgCl(s) ; K= [Ag+][Cl- ]= 1/Ks(AgCl) = 109,75 = 5,6 109. CrO42- + Ag+ = AgCrO4(s) ; K1= [Ag+][CrO42- ]= 1/Ks(CrO4) = 1011,95 = 8,9 1011. Concentrations initiales en ion chlorure [Cl-]0 et en ion chromate [CrO42-]0 : volume de 5 gouttes de chromate de potassium : environ 1 mL ; volume total : 10+50+1 = 61 mL [Cl-]0 =v0c0 / 61= c0 / 6 = 0,151/6,1= 2,48 10-2 mol/L ; [CrO42-]0 = c'/61 = 0,2/61 = 3,28 10-3 mol/L ; AgCl(s) apparaît dès que la concentration en ion argent vaut : Ks(AgCl) / [Cl-]0 =7,2 10-9 mol/L AgCrO4(s) apparaît dès que la concentration en ion argent vaut : Ks(CrO4) / [CrO42-]0 =3,4 10-10 mol/L Donc AgCl( s) précipite en premier. En conséquence, pratiquement tous les ions chlorure ont réagi lorsque la couleur rouge apparaît, justifiant ainsi le rôle d'indicateur de fin de réaction du chromate d'argent. Calcul de c0 : c véq = v0c0 soit c0 = c véq / v0= 0,1*15,1/10 = 1,51 10-1 mol/L. Réaction de saponification : Suivi conductimétrique de la cinétique d'une réaction de saponification entre l'éthanoate d'éthyle et l'hydroxyde de sodium. saponification de l'ester par l'hydroxyde de sodium, lente, totale. CH3-COO-C2H5 + Na+ + HO- ---> CH3-CO2- + Na+ + C2H5OH les produits sont l'alcool éthylique (ou éthanol ) et l'éthanoate de sodium.
cet ion hydroxyde possède un excès d'électrons ; il peut réagir facilement avec le carbone du groupe ester ( carbone possédant un défaut d'électrons). Cet ion hydroxyde constitue un site nucléophile. le carbone du groupe ester constitue un site électrophile. la saponification résulte de l'interaction entre ces deux sites.
étape 2 : élimination du groupe alcoolate CH3-CH2-O-. étape 3 : réaction acide-base entre l'acide carboxylique et l'ion alcoolate. La cinétique est du second ordre : un par rapport à chaque réactif. Les réactifs sont initialement dans des conditions stoechiométriques. On note c0 la concentration initiale de chaque réactif, x la concentration en ion éthanoate à la date t, k la constante de vitesse. Equation donnant la vitesse d'apparition de l'ion éthanoate : dx/dt = k[ HO-][CH3-COO-C2H5] = k(c0-x) (c0-x) = k (c0-x)2 ; séparer les variables dx/ (c0-x)2 = k dt puis intégrer entre les dates t0 et t : 1/(c0-x) -1/c0 = kt ; kt = x/ (c0(c0-x)) (1) On suit la réaction par conductimétrie : relation entre g0, goo, g, x et c0 ; g0 = lNa+[Na+]+ lHO-[HO-] = c0(lNa++ lHO-) goo = lNa+[Na+]+ lC2H5O-[C2H5O-] = c0(lNa++ lC2H5O- ) g = lNa+[Na+]+ lHO-[HO-] + lC2H5O-[C2H5O-] = lNa+c0+ lHO-(c0-x)+ lC2H5O- x g =c0(lNa++ lHO-) + lC2H5O- x - lHO- x = g0 + lC2H5O- x + lNa+ x - lNa+ x- lHO- x g = g0 +goo x/c0 - g0 x/c0 ; (g - g0 ) = x/c0 ( goo- g0 ) ; c0 /x = ( g0- goo )/ (g0 - g ) repport dans (1) : (1) s'écrit : k t c0 (c0/x-1) = 1 k t c0[( g0- goo )/ (g0 - g )-1]=1 ; k t c0 ( g- goo ) / (g0 - g ) = 1 ou bien : (g0-g) /(g-goo)= k c0 t. On mesure à différentes dates la conductivité g d'une solution obtenue en mélangeant rapidement V mL d'éthanoate d'éthyle à 2,00 10-2 mol/L avec V mL d'hydroxyde de sodium de même concentration. En traçant la courbe d'équation (g0-g) /(g-goo) = f(t) on obtient une droite de coefficient directeur kc0. Unité de k : (g0-g) /(g-goo) est sans dimension ; donc k c0 t est sans dimension t est en s ; c0 est en mol L-1 d'où k : L mol-1 s-1. |
|||
|
|
||||
|
|
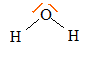 type AX2E2
donc en forme de V.
type AX2E2
donc en forme de V.