|
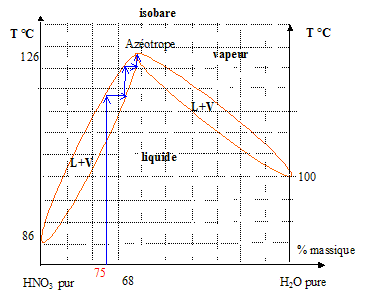
Système binaire HNO3-H2O : équilibre liquide-vapeur En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts. |
||
| .
. |
||
|
||
|
|
Les constantes physiques du système binaire HNO3-H2O sont les suivantes : T(ébullition) : HNO3 : 86°C sous une pression de 1 atm ; H2O : 100°C sous une pression de 1 atm; Azéotrope : 121°C sous pression de 1 atm . (composition en masse de l'azéotrope : 68% HNO3-32% H2O )
Les fractions molaires, molalité, molarité de HNO3 dans l'azéotrope : 68 g d'acide nitrique dans 100 g de solution. masse molaire acide nitrique : M= 1+14+3*16 = 63 g/mol Quantité de matière d'acide nitrique (mol) = masse / masse molaire = 68/63 = 1,08 mol molalité de l'acide nitrique : 10,8 mol dans 1000 g de solution : 10,8 mol / kg. 32 g d'eau dans 100 g de solution ; M(eau) = 18 g/mol) Quantité de matière (mol) d'eau : 32/18 = 1,78 mol d'où la fraction molaire en acide nitrique : 1,08/ (1,08+1,78) = 0,37. volume correspondant à 100 g de solution : 100 / densité = 100/1,4 = 71,4 mL = 0,0714 L molarité de l'acide nitrique : 1,08 /
0,0714 = 15,1 mol/L.
- de la vapeur qui par condensation et ébullition successives, s'enrichit en eau : le distillat final aura la composition de l'azéotrope ( queue de distillation). Par contre, la tête de distillation aura pratiquement la composition du mélange ( 75 % en masse d'acide nitrique) - Le bouilleur, par contre, va progressivement s'enrichir en acide nitrique.
|
|
|
|