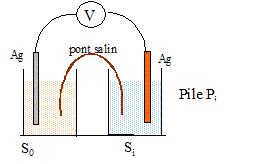
|
Agrégation physique chimie ( concours 2006 ) : pile de concentration stoechiométrie et la constante globale de formation bn du complexe Ag(NH3)2+ en solution aqueuse En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts. |
|||||||||||||||||||||||||||||||||
| .
. |
|||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||
|
|
But : déterminer la stoechiométrie et la constante globale de formation bn du complexe Ag(NH3)n+ en solution aqueuse. On considère les solutions Si ( i=0, 1, 2, 3) préparées de la manière suivante : dans une fiole jaugée de 100 mL, on place un volume v0 = 20 mL d'une solution de nitrate d'argent à c0=1,0 10-2 mol/L et un volume vi (mL) d'une solution d'ammoniac à 1 mol/L puis on complète au trait de jauge avec de l'eau distillée.
|
||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||
|
corrigé Equation bilan de la réaction globale de formation du complexe Ag(NH3)n+ dans la solution Si : Ag+ + n NH3 = Ag(NH3)n+ ; bn = [Ag(NH3)n+] / ([Ag+ ][NH3]n) Expression des concentrations à l'équilibre [Ag(NH3)n+]i et [NH3]i :
[NH3]i =( vi - nxéq) / 100 ; [Ag(NH3)n+]i = xéq / 100 ; or vi >> 0,2 ; (solution d'ammoniac concentrée) en conséquence : l'excès d'un réactif déplace l'équilibre vers la droite ( sens direct) et la réaction peut être considérée comme totale; de plus il se forme le complexe avec n le plus élevé. xéq = 0,2 mmol ; [Ag(NH3)n+]i
=0,2 / 100 = 2 10-3
mol/L ; [NH3]i
=( vi - 0,2 n) / 100 proche de 0,01vi
mol/L avec vi en mL.
E = E°(Ag+/Ag) + 0,06 log [Ag+]. pour la solution S0 : E0 = E°(Ag+/Ag) + 0,06 log [Ag+]0. pour la solution Si : Ei = E°(Ag+/Ag) + 0,06 log [Ag+]i. DEi= Ei-E0 = 0,06 log ( [Ag+]i / [Ag+]0) DEi est négatif car dans la solution Si, l'ion argent est sous forme complexe. [Ag+]i < [Ag+]0. avec [Ag+]0 = c0/5 = 2,0 10-3 mol/L ; bn = [Ag(NH3)n+]i / ([Ag+ ]i[NH3]in) soit [Ag+]i = [Ag(NH3)n+]i / (bn[NH3]in) voisin de 2 10-3/(bn(0,01 vi)n) DEi= -0,06 log (bn(0,01 vi)n) = -0,06 log bn - 0,06n log (0,01 vi) DEi permet de déterminer les valeur de n et bn : on trace la droite d'équation DEi= f(log (0,01 vi)
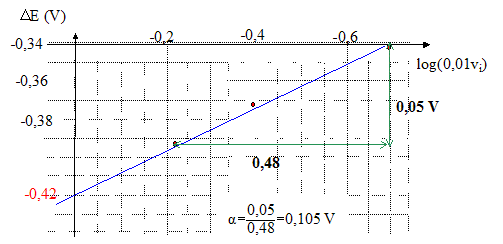
le coefficient directeur donne : 0,06n =0,105 et l'ordonnée à l'origine donne -0,06 log bn = -0,42 V d'où n = 0,105/0,06 = 1,73 ( n étant entier, on prend n=
2) et log bn
= 0,42/0,06 = 7 ; bn
=107.
Montrons que dans les conditions de l'expérience on peut négliger la formation de ce complexe b1 = [Ag(NH3)+]i / ([Ag+ ]i[NH3]i) ; [Ag(NH3)+]i = b1[Ag+ ]i[NH3]i avec [Ag+ ]i = 2 10-3/(b2(0,01 vi)2) = 2 10-6 / vi2 ; [NH3]i = 0,01 vi ; [Ag(NH3)+]i = 103,4* 2 10-8 / vi = 2 10-4,6 / vi =5 10-5 / vi. on trouve des valeurs voisines de 10-6 mol/L , alors que [Ag(NH3)2+]i = 2 10-3 mol/L.
|
|||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||