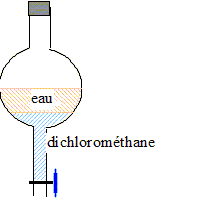|
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| .
. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
On dispose de trois solvants : dichlorométhane, éthanol et éther éthylique.
Les deux solvants ne doivent pas être miscibles, avoir des densité différentes et l'espèce à extraire ( l'acide benzoïque dans ce cas) doit être peu soluble dans l'eau et très solubles dans l'autre solvant ( le dichlorométhane et l'éther répondent à ces conditions). Extraction simple : Dans une ampoule à décanter, on introduit un volume V0 = 40 mL de la solution S0 d'acide benzoïque de concentration en soluté apporté C0=1,0 10-2 mol/L. Quantité de matière d'acide benzoïque n0 = V0 C0 = 0,04 * 0,01 = 4 10-4 mol On ajoute un volume V = 10,0 mL de dichlorométhane . On bouche l'ampoule, on l'agite et on la retourne ( on ouvre le robinet pour dégazer) et cela plusieurs fois. On repose l'ampoule sur son support ; on retire le bouchon. les deux phases dans l'ampoule à décanter : Le liquide le plus dense, le dichlorométhane contenant
la majorité de l'acide benzoïque occupe la partie inférieure. On recueille V1= 40 mL de la phase aqueuse et on dose l'acide benzoïque qu'elle contient par une solution de soude. La concentration en acide benzoïque dans cette phase aqueuse est Caq= 1,0 10-3 mol/L La quantité de matière d'acide benzoïque restant dans la phase aqueuse vaut : V1 Caq = 0,04* 10-3 = 4 10-5 mol. La quantité de matière d'acide benzoïque passée dans la phase organique vaut : norg=4 10-4- 4 10-5 = 3,6 10-4 mol. La concentration en acide benzoïque dans cette phase organique est Corg= norg/ V= 3,6 10-4 /0,01 =3,6 10-2 mol/L coefficient de partage k : ( ne dépend que de la température et de la nature des solvants) rapport des concentrations molaires d'une espèce notée E dans deux phases aqueuse et organique non miscibles : k = [E]org / [E]aq . [acide benzoïque]org = 3,6 10-2 mol/L ; [acide benzoïque]aq =10-3 mol/L ; k1= 3,6 10-2 / 10-3 = 36 rendement de cette extraction r1 = norg / n0*100 = 3,6 /4 *100 = 90%.
On introduit un volume V0= 40 mL de solution S0 dans l'ampoule à décanter. On ajoute V2 = 5,0 mL de dichlorométhane et on procède comme ci-dessus. On recupère la phase aqueuse. On effectue une seconde extraction de cette phase aqueuse avec un volume V2 = 5,0 mL de dichlorométhane. On recueille V1= 40 mL de la phase aqueuse et on dose l'acide benzoïque qu'elle contient par une solution de soude. La concentration en acide benzoïque dans cette phase aqueuse est C'aq= 2,5 10-4 mol/L La quantité de matière d'acide benzoïque restant dans la phase aqueuse vaut : V1 C'aq = 0,04* 2,5 10-4 = 10-5 mol. La quantité de matière d'acide benzoïque passée dans la phase organique vaut : n'org=4 10-4- 10-5 = 3,9 10-4 mol. La concentration en acide benzoïque dans cette phase organique est C'org= n'org/ V= 3,9 10-4 /0,01 =3,9 10-2 mol/L rendement de cette extraction r1 = n'org / n0*100 = 3,9 /4 *100 = 98%. Pour un même volume de solvant d'extraction (V = 10 mL), il vaut mieux fractionner les extractions et réaliser deux extractions successives avec chacune 5 mL de solvant. L'extraction en deux voir plusieurs étapes donne un rendement meilleur ; de plus elle ne consomme pas d'avantage de solvant. l'acide benzoïque peut être identifié : soit par chromatographie sensible aux UV soit par la mesure du point de fusion du solide sur un banc Kofler. calculs : k= 36 ; n0 = 4 10-4 mol dans V0=40 mL 1ère extraction : V = 5 mL dichlorométhane
concentration en acide benzoïque dans la phase organique est Corg= xéq / V k = Corg / Caq= xéqV0/ ((n0-xéq) V) ; 36 = 40xéq /((4 10-4 -xéq)*5 ) d'où xéq = 3,27 10-4 mol ; n0-xéq=7,3 10-5 mol 2ème extraction : V = 5 mL dichlorométhane
concentration en acide benzoïque dans la phase organique est Corg= x'éq / V k = C'org / C'aq= x'éqV0/ ((7,3 10-5-x'éq) V) ; 36 = 40x'éq /((7,3 10-5 -x'éq)*5 ) d'où x'éq = 5,97 10-5 mol ; 7,3 10-5 -x'éq = 1,3 10-5 mol rendemnt des deux extractions : (4 10-4 - 1,3 10-5 ) / 4 10-4 *100 = 97 %
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|