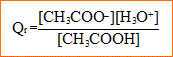|
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
||||||||||||||||||||||||
| .
. |
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
|
acide chlorhydrique ( H3O+ aq ; Cl- aq) : S1 c1=5,0 10-3 mol/L et conductivité s1=200 mS/m ; S'1 c'1=1,0 10-3 mol/L et conductivité s'1=40 m S/m On remarque : lorsque la concentration de cet acide est divisée par 5, la conductivité est également divisée par 5 : les ions ne réagissent pas avec l'eau acide éthanoïque (CH3COOH) : S2 c2=5,0 10-3 mol/L et conductivité s2=11 m S/m ; S'2 c'2= 1,0 10-3 mol/L conductivité s'2=4,6 m S/m On remarque : lorsque la concentration de cet acide est divisée par 5, la conductivité est divisée par 2 : l'un des ions présents en solution réagit avec l'eau La transformation chimique ayant lieu entre l'acide éthanoïque et l'eau est associée à la réaction acido basique suivante CH3COOH + H2O = CH3COO- + H3O+ quotient de réaction : Tableau de suivi de l'évolution de la transformation : on considère V= 1 L de solution
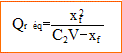
expression de la conductivité s2 de la solution aqueuse d'acide éthanoïque en fonction de xf : seuls les ions apportent une contibution à la conductivité : s2= l H3O+ [H3O+] + l CH3COO- [CH3COO-] . s2= l H3O+ xf / V + l CH3COO- xf / V =(l H3O+ + l CH3COO-)xf / V. Rappel V = 1 L En considérant totale l'ionisation des ions de l'acide éthanoïque dans l'eau, les conductivités respectives théoriques des solutions S2 et S'2 seraient : l H3O+ =35 10-3 S m² mol-1 ; l CH3COO-= 4 10-3 S m² mol-1 ; C2=5,0 10-3 mol/L ; C'2=1,0 10-3 mol/L dans ce cas xf = x max = C2V ; s°2= (l H3O+ + l CH3COO-)C2 =195 10-6 S/m et s'°2= (l H3O+ + l CH3COO-)C'2 =39 10-6 S/m Expression des conductivités réelles (mesurée) s2 et s'2 des solutions S2 et S'2, en fonction de xf : s2= (l H3O+ + l CH3COO-)xf =39 10-3 xf S/m ; s'2= (l H3O+ + l CH3COO-)x'f = 39 10-3 x'f S/m ; d'où : xf = s2 / s°2 =11 10-3 /39 = 2,8 10-4 mol ; xf = s2 / s°2 = 4,6 10-3 /39 = 1,2 10-4 mol ; valeur du quotient de réaction à l'équilibre : solution S2 : (2,8 10-4 )2 / ( 5 10-3 - 2,8 10-4) = 1,6 10-5. solution S'2 : (1,2 10-4 )2 / ( 10-3 - 1,2 10-4) = 1,6 10-5. Le quotient de réaction à l'équilibre prend la même valeur pour les deux solutions. Cette valeur est égale à la constante d'acidité du couple acide base CH3COOH/ CH3COO-
|
|||||||||||||||||||||||
|
|