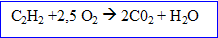Une lampe a carbure est un ancien dispositif d'éclairage : on alimentait la lampe en carbure de calcium solide CaC2 qui au contact de l'eau donne un gaz combustible, l'acétylène C2H2.
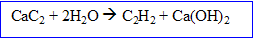
1. Le carbure de calcium contient environ 25 % d'impuretés : calculer la masse puis la quantité de matière (mol) de carbure de calcium contenu dans 100g de carbure du commerce. Ca : 40 ; C : 12 ; H : 1,0 g/mol
Masse de carbure pur : 100*0,75 = g.
Masse molaire du carbure de calcium CaC2 : 40 + 2*12 = g/mol.
Quantité de matière (mol) = masse (g) par la masse molaire (g/mol) =75/64 = mol. ( valeur réelle 1,172)
2. Quelle est la quantité d'acétylène obtenue ?
D'après les coefficients de l'équation bilan, la quantité de matière de carbure est à la quantité d'écéthylène soit 1,2 mol.
3. La lampe consomme 1 L de gaz par minute. La lampe fonctionne pendant une demi-heure. Quel est le volume molaire des gaz dans ces conditions ?
En une demi-heure la lampe consomme L de gaz.
Or la quantité de matière (mol) d'un gaz = volume du gaz (L) par le volume molaire des gaz ( L/mol). D'où :
volume molaire = volume du gaz / quantité de matière = 30 /1,172 = L/mol
4. Quelle est la masse minimale d'eau ?
D'après les coefficients de l'équation bilan, la quantité de matière d'eau est fois plus grande que celle de carbure soit : 1,172 *2 = 2,344 mol d'eau
masse (g) d'eau = quantité de matière (mol) fois masse molaire de l'eau (g/mol) = 2,344*18 = g.
5. Quelle est la masse d'hydroxyde de calcium produite ?
D'après les coefficients de l'équation bilan, la quantité de matière d'hydroxyde de calcium est à celle de carbure soit 1,172 mol
Masse molaire Ca(OH)2 : 40+2*17 = 74 g/mol
masse (g) = masse molaire (g/mol) * quantité de matière (mol) = 74*1,172 = g.
6. Ecrire l'equation de cette reaction de la combustion de l'acéthylène dans le dioxygène de l'air sachant qu'elle fournit du dioxyde de carbone et de l'eau .