En diluant les solutions commerciales pures d'acide formique (HCOOH) et d'acide nitrique (HNO3), on prépare deux solutions de même concentration molaire apportée C= 1,0*10^-2 mol/L.
A 25°C on mesure la conductance de ces solutions. Constante de cellule du conductimètre k = 1,0*10^-2 m. G1 = 4,8*10^-4 S (acide formique) et G2= 4,2.10^-3 S.
Densité des solutions commerciales :
- acide formique : d= 1,22 ; masse molaire M=46 g/mol
- acide nitrique: d = 1,52 ; masse molaire M= 63 g/mol.
1. Quels volumes V1 et V2 de solutions commerciales faut-il prélever pour obtenir 1,0 L de solutions d'acide formique et nitrique de concentration molaire C= 1,0*10^-1 mol/L.
- Quantité de matière (mol) d'acide dans les solutions commerciales :
1 L d'acide formique a une masse de 1220 g.
Qté de matière (mol) = masse (g) par la masse molaire (g/mol) = 1220 / 46 = 26,52 mol d'acide formique
Facteur de = concentration mère divisé par la concentration fille = 26,52 / 0,1 = 265,2
Volume à prélever à la pipette jaugée =V1 = volume de la solution fille / facteur de dilution = 1000 / 265,2 = mL
De même pour l'acide nitrique : 1520 / 63 = 24,12 mol ; F= 24,12 / 0,1 = 241,2 ; V2 = 1000/241,2 = mL.
2. Quel est le mode opératoire permettant de préparer 100 mL des solutions étudiées par conductimétrie ?
Facteur de dilution =F= 10
Fiole 100 mL et pipette jaugée de 100 / F= 10 mL
Prélever 10 mL de chaque solution précédente à l'aide d'une pipette jaugée ; placer dans la fiole jaugée ;
compléter à l'aide d'eau distillée jusqu'au trait de jauge ; agiter pour rendre homogène.
3. Ecrire les équations chimiques des réactions de chaque acide sur l'eau.
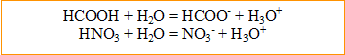
4. Etablir le tableau d'avancement descriptif en notant l'acide AH. En déduire l'avancement maximal.
1-Xmax = 0 soit Xmax =
mmol
5. Les conductances permettent de calculer l'avancement final dans l'état d'équilibre ainsi que le taux d'avancement final. Faire les calculs et conclure.
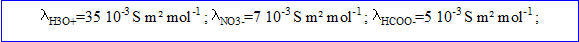
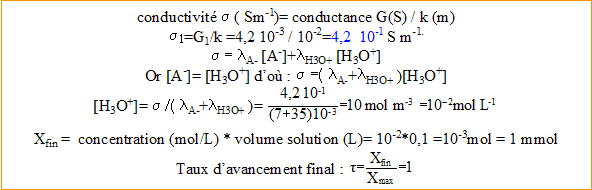
L'acide nitrique est entièrement dissocié dans l'eau ; la réaction de l'acide nitrique sur l'eau est
.
Un calcul identique pour l'acide formique donne : [ion oxonium]=1,2 10^-3 mol/L ; Xfin = 1,2 10^-4 mol =0,12 mmol
Taux d'avancement final = 0,12
L'acide formique réagit
avec l'eau.
6. Quel est le pH de chaque solution ?
acide nitrique : pH= - log 0,01 =
.
acide formique : pH = - log (0,0012) =
.
7. Donner l'expression du quotient de réaction de l'acide formique et calculer son pKa.
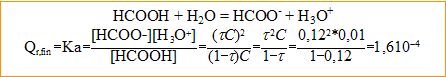
pKa = - log Ka = -log (1,6 10^-4) = 3,8.