1. On prépare V = 100 mL de solution aqueuse de permanganate de potassium, notée S de concentration en soluté apporté C = 0,10 mol/L, à partir d’une solution aqueuse de permanganate de potassium de concentration 0,50 mol/L.
Décrire la préparation de cette solution S.
Facteur de dilution ( nombre à 1) : F= concentration mère divisée par concentration fille
F= 0,5/0,1 = 5
De plus F = volume de la fiole jaugée (mL) / volume de la pipette jaugée
D'où le volume de la pipette : 100 / 5 = 20 mL
Prélever 20 mL de solution mère à la pipette jaugée + .
Introduire dans la fiole jaugée de 100 mL, compléter avec de l'eau jusqu'au trait de jauge.
Agiter pour rendre homogène.
2.On prépare 100 mL de solution aqueuse de nitrite de colbat III et de sodium de concentration molaire en soluté apporté c' = 0,25 mol/L, en dissolvant une masse m de solide dans l'eau distillée. 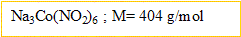 .
.
- Calculer m
- Quelles sont les concentrations des ions ?
Quantité de matière (mol) = concentration (mol/L) volume de la solution (L) = 0,25*0,1 = 0,025 mol
Quantité de matière (mol) = masse divisée par la masse molaire (g/mol)
D'où : m= n M = 0,025*404 = 10,1 g.
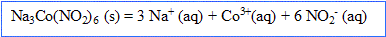
D'après les coefficients stoechiométriques, la quantité de matière d'ion nitrite est égale à : *0,025 = 0,15 mol dans 0,1 L
Concentration en ion nitrite : quantité de matière (mol) / volume de la solution (L) = 0,15 / 0,1 = 1,5 mol/L.
De même : concentration en ion cobalt III : 0,025 / 0,1 = 0,25 mol/L
concentration en ion sodium : 3*0,025/0,1 = 0,75 mol/L
3. On mélange les deux solutions précédentes. Le milieu est acidifié( excès d'acide).
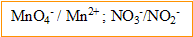
- Ecrire les demi-équations associées à ces couples puis l'équation de la réaction.
- Préciser quel est l'oxydant, quel est le réducteur.
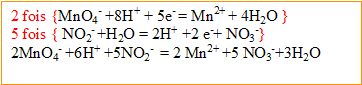
L'ion permanganate joue le rôle d' : il gagne des électrons et se réduit.
L'ion nitrite joue le rôle de : il cède des électrons et s'oxyde.
- Etablir le tableau d'évolution et en déduire le réactif en défaut.
| avancement (mol) | 2 | + 8  | + 5  | = 2 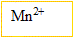 | + 5  | + 3  |
| initial | 0 | CV=0,1*0,1 = 0,01 | excès | 1,5*0,1 = 0,15 | 0 | 0 | solvant |
| en cours | X | 0,01-X | | 0,15-X | X | 5X | en excès |
| fin | Xmax | 0,01-2Xmax | | 0,15-5Xmax | 2Xmax | 5 Xmax | |
Si l'ion permanganate est en défaut : 0,01 - 2Xmax=0 soit Xmax = 0,005 mol
Si l'ion nitrite est en défaut : 0,15 -5 Xmax = 0 soit Xmax = 0,03 mol
On retient la plus petite valeur : l'ion permanganate est en défaut ; l'ion nitrite est en
.
- Déterminer les concentrations finales de tous les ions présents.
Quantité de matière finale :
- ion nitrite : 0,15-5*0,005 = 0,125 mol
- ion nitrate : 5*0,005 = 0,025 mol
- ion manganèse II : 2*0,005 = 0,01 mol
volume de la solution : 200 mL =
L
[ion nitrite] = 0,125/0,2 = 0,63 mol/L
[ion nitrate]= 0,025/0,2 = 0,13 mol/L
[ion manganèse II] = 0,01 / 0,2 = 0,05 mol/L
Les concentrations des ions spectateurs ( ion potassium, ion cobalt III et ion sodium) sont égales à la moitié de leurs valeurs initiales du fait de la
( le volume du mélange est le double de chaque volume initial)