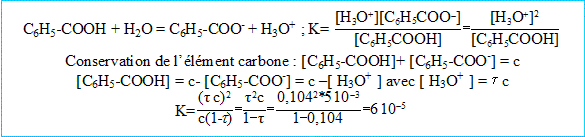La cellule d'un conductimetre (S=1,0 cm², L=1,0 cm) plongeant dans une solution d'acide benzoique mesure la conductance G=2,010^-4 S.
concentration en soluté apporté : c=5,010^-3 mol/L
Conductivites molaires ionique : 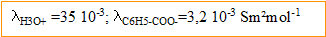
1. Ecrire l'équation de la réaction entre l'eau et l'acide benzoïque.
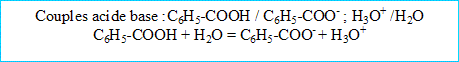
2. Quelles sont les concentrations des ions en solution ?
En milieu les ions hydroxydes sont minoritaires.
La solution est électriquement : 
La constante de la cellule du conductimètre vaut : k= L(m) / S( m²) =0,01 / 10^-4 =100 m-1.
La conductivité ( S/m) est à la conductance (S)
conductivité "sigma" = k G = 100*2 10^-4 = 0,020 S/m.
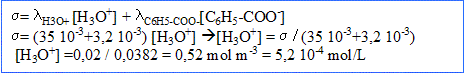
3. Quel est le taux d'avancement final de la réaction ?
La concentration en ion oxonium est égale à la concentration en soluté apporté fois le taux d'avancement final.
Taux d'avancement final = concentration en ion oxonium par la concentration en soluté apporté = 5,2 10^-4 / 5 10^-3 = 0,10.
( On conserve une valeur plus précise 0,104 pour la suite des calculs)
4. Quelle est l'expression de la constante d'équilibre K de la réaction ci-dessus. Calculer K.