|
d'après
concours technicien
chimiste Lille 2006
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
|
.
.
|
|
|
|
Problèmes
1et 2 :
- Que représente le nombre de masse ?
A- Le nombre total d'électrons et de protons.
B- Le nombre total de
neutrons et de protons. exact
C- La différence entre les protons et les
neutrons.
D- La différence entre les protons et les électrons.
- Lequel des composés chimiques suivants ne possède pas
de liaison covalente ? CH4 ; NH3
; KCl
; O2.
- Quels sont parmi les solides suivants ceux qui sont
isolants ? le cuivre, le
verre, le bois, le fer, l'or.
- Quelle est, parmi les températures ci-dessous celle
qui est la plus proche de la température d'ébulliton de l'azote liquide
? ( à la pression atmosphèrique)
-20°C ; -80°C ; 20°C ; -190°C
; -290°C ; -350°C.
- Quelles sont les propositions vraies concernant un
cahier de laboratoire ?
a- Noter uniquement les manipulations réussies.
B- Consigner toutes les
expériences.
C- Appartient au
laboratoire.
D- Contenir uniquement les résultats.
- Quel est selon vous le plus important ( une seule
réponse) ?
A- Avoir beaucoup d'imagination.
B- Travailler sur des
données fiables.
C- Savooir bien mettre en valeur les résultats.
D- Travailler vite.
- Vous préparz sur un mélange réactionnel et vous
craignez d'avoir oublié un réactif. Que faîtes vous ? ( une seule
réponse)
A- Vous ne gachez pas de matériel et vous poursuivez.
B- Les erreurs arrivent toujours, ce n'est pas grave.
C- Vous refaîtes le
mélange réactionnel.
D- Vous ajoutez le réactif que vous pensz avoir oublié.
- Quels sont les différents type d'extincteurs présents
dans un laboratoire ?
- Lequel faut-il utiliser pour éteindre un feu électrique, un feu de
solvant organique ?
- Que faire devant un collègue ayant les vétements en feu ?
- Les réactions en chimie organique se font souvent
avec des solvants anhydres. On veur sécher du tétrahydrofuranne ( Eb=66°C)
par distillation sur sodium.
- Quelles sont les précautions à prendre ?
- Comment éliminez-vous les résidus de sodium après distillation ?
- Sur un flacon de produit chimique il est écrit "
causes severe burns. Avoid contact with skin and eyes. In case of
contact with eyes, rinse immediately of water and seek medical advise
immediately ".
Vous devez peser 45 g de ce produit dans un bécher. Quelles précautions
prenez vous ? ( une seule réponse)
A- Vous mettez des gants. B- vous mettez des lunettes . C- vous mettez
un masque ; D- vous mettez des gants et un masque ; E- vous mettez des
lunettes et des gants ; F- vous n'y touchez pas et demandez un autre
produit ; G- vous demandez un anglophone.
- Indiquez parmi les produits suivants ceux qui peuvent
être stockés sans risque dans les mêmes casiers ou armoires.
A- acide sulfurique 98% et hydroxyde de sodium.
B- hydroxyde de sodium et hydroxyde de potassium.
C- cyanure de potassium et acide chlorhydrique 37%.
D- méthanol et éthanoate de méthyle.
E- eau de javel et acide éthanoïque.
corrigé
Les
feux sont classés en 4 classes: A : feux de solides ; B : feux de
liquides ; C : feux de gaz ; D : feux de métaux. On y ajoute les feux
d'origine électrique E.
|
agents extincteurs
|
type de feux
|
|
A
|
B
|
C
|
D
|
E
|
|
eau pulvérisée
|
X
|
|
|
|
|
|
eau pulvérisée avec additif AFFF
|
X
|
X
|
|
|
|
|
poudre BC
|
X
|
X
|
X
|
|
|
|
poudre ABC
|
X
|
X
|
X
|
|
|
|
poudre spéciale
|
|
|
|
X
|
|
|
dioxyde de carbone CO2
|
|
|
X
|
|
X
|
devant un collègue ayant les vétements en feu
: le couvrir d'une couverture pour étouffer le feu.
Les réactions en
chimie organique se font souvent avec des solvants anhydres. On veur
sécher du tétrahydrofuranne ( Eb=66°C) par
distillation sur sodium.
Précautions à prendre : absence d'eau en
quantité trop importante ( présséchage du solvant sur MgSO4
anhydre), le sodium réagit violemment avec l'eau
Eliminer les résidus de sodium après distillation
: en présence d'éthanol absolu, le sodium donne un alcoolate C2H5O-;
Na+.
Sur un flacon de
produit chimique il est écrit " causes severe burns. Avoid contact with
skin and eyes. In case of contact with eyes, rinse immediately of water
and seek medical advise immediately ".
Vous devez peser 45 g de ce produit dans un bécher.
"cause des brûlures graves. Évitez le contact avec la
peau et les yeux. En cas de contact avec des yeux, rincez immédiatement
de l'eau consulter un médecin"
vous mettez des lunettes et des gants.
Indiquez parmi les
produits suivants ceux qui peuvent être stockés sans risque dans les
mêmes casiers ou armoires.
- l'acide sulfurique 98% et hydroxyde de sodium : réaction acide base
d'autant plus exothermiquesque les réactifs sont plus concentrés,
armoires séparées.
- hydroxyde de sodium et hydroxyde de potassium : deux bases rangées
dans la même armoire.
- cyanure de potassium et acide chlorhydrique 37% : la réaction conduit
à un dégagement de HCn, gaz toxique : armoires séparées.
- méthanol et éthanoate de méthyle : alcool + ester ( pas de réaction)
mais le méthanol est un poison ( il faut le mettre dans l'armoire aux
poisons)
- eau de javel et acide éthanoïque :( pas de réaction) par contre avec
l'acide chlorhydrique, l'eau de javel conduit au dichlore, gaz toxique.
|
|
Problème 3 :
- L'ensemble des chercheurs de votre laboratoire
utilise 22,5 g d'un produit chimique chaque semaine. Vous êtes chargé
de tenir le stock et d'approvisionner ce produit en ayant six mois
d'avance. Ce produit est vendu en flacon de 100 g au prix de 179 euros
l'unité.
- Combien de flacons devez vous commander pour approvisionner le stock ?
- Quel sera le montant pour une année ?
- Un volcan émet 2000 tonnes de dioxyde de soufre par
jour. Donner la formule chimique de ce composé.
- Sachant que 0,2 % en poids de soufre sont relachés par kg de magma,
calculez la masse de magma dégazé ar jour ?
- Quel est le volume de magma correspondant ( en m3)
si la masse volumique de ce dernier est 2,6 tonnes / m3
? S: 32 ; O : 16 g/mol.
corrigé
flacons à commander pour approvisionner le stock :
6 mois = 26 semaines soit une masse de 22,5*26 =585 g
soit six flacons de 100 g
montant pour une année :
12 flacons à 179 euros l'unité soit 179*12 =2148 euros.
dioxyde de soufre : SO2 ( M= 32+2*16 =
64 g/mol)
Quantité de matière
SO2 : masse (g) / masse molaire (g/mol) = 2 109
/ 64 =3,125 107 mol
Quantité de matière
de soufre : 3,125 107 mol
masse de soufre (g) =
masse molaire (g/mol) * quantité de matière (mol) = 32*3,125 107
= 109 g =106 kg = 1000
tonnes.
masse de magma dégazé ar jour : à 1 tonne de magma correspond 2 kg de
soufre
106/2
= 5 108 kg = 5 105 tonnes de magma.
volume de magma (m3)
: masse (tonnes) / masse volumique ( tonne m-3)
= 5 105 /2,6 =1,9
105 m3.
|
|
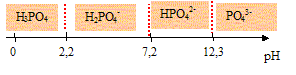
acide
phosporique ; solution tampon :
L'acide orthophosphorique H3PO4
est un triacide dont les pKa sont pKa1
= 2,2 ; pKa2 = 7,2 ; pKa3
= 12,3.
- Représenter sur un axe horizontal, les domaines de
prédominance des espèces H3PO4,
H2PO4-,
HPO42- et PO43-.
- Vous désirez préparer 1 L de tampon phosphate 0,05
mol/L à pH=7,2. Vous disposez de NaH2PO4,2H2O
d'une puteté de 98 %, de Na2HPO4,12H2O
et d'eau distillée. De quelle façon procédez vous ? Indiquer
succinctement les étapes nécessaires ainsi que les résultats de calculs
éventuels.
- Quelles sont les propriétés d'une solution tampon ?
H : 1 ; O : 16 ; Na : 23 ; P : 31 g/mol.
corrigé
les domaines de prédominance des espèces H3PO4,
H2PO4-,
HPO42- et PO43-
:
Vous désirez préparer 1 L de tampon phosphate 0,05 mol/L
à pH=7,2. Vous disposez de NaH2PO4,2H2O
d'une puteté de 98 %, de Na2HPO4,12H2O
et d'eau distillée. Les étapes nécessaires ainsi que les résultats de
calculs éventuels :
[H2PO4-]
= [HPO42-]
Mélanger 0,5 L de solution de NaH2PO4
à 0,1 mol/L et 0,5 L de solution de Na2HPO4
à 0,1 mol/L ; dans le mélange ( facteur de dilution = 2) , les
concentrations de chaque ion seront : 0,05 mol/L
Quantité de matière (mol) correspondante = volume (L) *
concentration (mol/L) : n = 0,1*0,5 = 0,05 mol
masse molaire NaH2PO4,2H2O
: M= 23+2+31+64+2*18 = 156 g/mol
masse (g) = M*n= 156*0,05 = 7,8 g
masse à peser, en tenant compte de la pureté : 7,8 /
0,98 = 7,96 g.(
dissoudre dans 0,5 L d'eau distillée)
masse molaire Na2HPO4,12H2O
: M= 46+1+31+64+12*18 = 358 g/mol
masse (g) = M*n= 358*0,05 =17,9
g.
Propriétés d'une solution tampon :
modère la variation du pH, faisant suite à l'ajout
modéré d'acide ou de base forte.
le pH ne varie pas par dilution.
|
|
Electrolyse
à anode soluble :
On réalise le montage ci-dessous. Le générateur de
tension continue permet de faire circuler un courant d'intensité I.
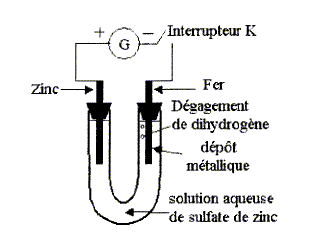
- Faire le bilan des espèces présentes dans le milieu.
L'interrupteur est fermé. On observe alors sur l'électrode de fer la
formation d'un dépôt métallique et un dégagement d'hydrogène.
- Indiquer le sens de circulation des porteurs de
charge dans la solution et dans les fils de connexion. Préciser leurs
noms.
- Ecrire les demi-équations des réactions se produisant
à l'électrode de fer. Cette électrode est-elle la cathode ou l'anode ?
Justifier.
- Quel est l'intérêt pratique de ce dépot métllique sur
lélctrode de fer ?
- Comment évolue la masse de l'électrode de zinc ?
Justifier en écrivant la demi-réaction qui se produit sur l'électrode
de zinc.
Le générateur délivre un courant d'intensité I= 0,5 A pendant t=10 min.
Dans cette électrolyse dite " à anode soluble " calculer :
- La quantité d'électricité Q échangée pendant 10 min
et en déduire la quantité de matière d'électrons échangée ne.
- Quelle relation existe t-il entre la quantité de
matière de zinc ayant disparu et la quantité d'électrons échangés ?
- Calculer la variation de masse de l'électrode de zinc.
Zn : 65,4 g/mol ; NA= 6,02 1023
mol-1 ; e= 1,6 10-19 C.
corrigé
bilan
des espèces présentes dans le milieu :
A l'anode, reliée à la borne positive du générateur :
zinc métal de l'électrode, Zn2+, SO42-,
H2O.
A la cathode de fer : fer de l'électrode, Zn2+,
SO42-, H2O.
sens de circulation des porteurs de charge dans
la solution et dans les fils de connexion :
dans le circuit extérieur, les électrons vont du pôle -
vers le pôle + du générateur.
Dans la solution, les ions sulfates SO42-
se déplacent du fer vers l'électrode de zinc ; les ions Zn2+
se déplacent du zinc vers l'électrode de fer.
demi-équations des réactions se produisant à
l'électrode de fer : réduction donc cathode
Zn2+ + 2e-
= Zn(s) et 2H2O + 2e- = H2
(g) + 2HO-.
Intérêt pratique de ce dépot métllique sur
lélctrode de fer : protection du fer contre la corrosion.
demi-réaction qui se produit sur l'électrode de
zinc : oxydation donc anode
Zn(s) = Zn2+ + 2e-
; la masse de l'électrode diminue.
Le générateur délivre un courant d'intensité I= 0,5 A
pendant t=10 min.
Quantité d'électricité Q échangée pendant 10 min : Q=It
= 0,5*60*10 = 300 C
Valeur absolue de la charge d'une mole d'électrons : NA
e = 6,02 1023 * 1,6 10-19
=9,632 104 C
Quantité de matière d'électrons échangée ne
= 300 / 9,632 104 =3,11 10-3
mol
Relation entre la quantité de matière de zinc ayant
disparu et la quantité d'électrons échangés :
Zn(s) = Zn2+ + 2e-
; d'où n(Zn) = ½ne = 3,11 10-3
/2 = 1,56 10-3 mol
Diminution de masse de l'électrode de zinc : n(Zn) M =
1,56 10-3 *65,4 = 1,02
10-1 g.
|
|
Dosage
de nitrates dans un engrais :
On réalise l'étude d'un engrais solide portant comme
indications : engrais NPK 17.17.17
17 % d'azote total ; 17 % d'anhydride phosphorique P2O5
; 17 % d'oxyde de potasse K2O.
- Donner les expressions littérales permettant de
déterminer les pourcentages massiques en phosphore et en potassium de
cet engrais.
Les nitrates s'accumulent dans notre environnement. Dans l'organisme
ils peuvent être transformés en nitrites NO2-
qui peuvent entraînés la formation de nitrosamines cancérigènes.
- Ecrire la demi-équation électronique de
transformation des ions nitrate en ions nitrite en milieu acide.
L'acide orthophosphorique H3PO4 peut
être obtenu par combustion du phosphore dans le dioxygène : il se forme
le décaoxyde de tétraphosphore, dont l'hydratation donne l'acide
orthophosphorique.
- Ecrire et équilibrer les équations de ces deux
réactions.
Cet acide est obtenu industriellement par action de l'acide sulfurique
sur le phosphate de calcium.
- Ecrire et équilibrer l'équation de cette réaction.
Dosages des
nitrates dans un engrais :
Principe du dosage : il s'agit d'un dosage retour.
On porte à ébullition en milieu acide, une masse connue d'engrais en
présence d'une quantité connue et en excès d'ion Fe2+.
Une partie de ces ions est oxydée en ion Fe3+
tandis que les ions nitrate sont réduits en monoxyde d'azote.
- Ecrire les deux demi-équations puis le bilan de cette
réaction.
Les ions Fe2+ restants sont ensuite dosés par
une solution de dichromate de potassium de concentration C3.
- Ecrire les deux demi-équations puis le bilan de cette
réaction.
Préparation de la
solution d'engrais :
l'engrais commercial se présente sous la forme de granulés. On pèse1,25
g de granulés. on les écrase au mortier et on dissout la poudre obtenue
dans 100 mL d'eau. Soit V0 le volume de cette
solution.
Préparation de la
solution de Fe2+:
On pèse avec précision 7,845 g de sel de Mohr ( Fe(NH4)2(SO4)2,
6H2O qu'on dissout dans 100 mL d'eau acidifiée
par H2SO4.
- Calculer la concentration C2
des ions Fe2+ de la solution ainsi préparée.
Dosage des
nitrates :
Dans un becher on verse : V1= 10 mL de la
solution d'engrais ; V2 = 10 mL de la solution
de sel de Mohr ; 15 mL d'acide sulfurique dilué.
On chauffe le becher et on maintient à une ébullition une dizaine de
minutes. On refroidit ensuite, on ajoute un peu d'eau, quelques gouttes
d'indicateur et on dose les ions Fe2+ en excès
par la solution de dichromate de potassium de concentration C3
= 1/60 mol/L. Le volume V3 de dichromate versé
est V3 = 7,4 mL
- Montrer que la masse d'azote (m) contenue dans la
solution préparée, sous forme de nitrate est : m= 14/3 (C2V2-6C3V3)V0/V1
10-3 si les volumes sont exprimés en mL.
- Calculer le pourcentage d'azote sous forme de nitrate
dans cet engrais.
H : 1 ; O : 16 ; N : 14 ; K : 39,1 ; S : 32 ; P : 31 ; Fe : 55,85 g/mol
corrigé
Expressions
littérales permettant de déterminer les pourcentages massiques en
phosphore et en potassium de cet engrais :
17 % d'anhydride phosphorique P2O5
d'où : % massique P =17* 2M(P) / M(P2O5)
avec M : masse molaire (g/mol)
17 % d'oxyde de potasse K2O d'où
: % massique K =17* 2M(K) / M(K2O)
Les nitrates s'accumulent dans notre environnement. Dans
l'organisme ils peuvent être transformés en nitrites NO2-
qui peuvent entraînés la formation de nitrosamines cancérigènes.
Demi-équation électronique de transformation
des ions nitrate en ions nitrite en milieu acide :
NO3- + 2H+
+ 2e- = NO2-+
H2O réduction de l'ion nitrate.
L'acide orthophosphorique H3PO4
peut être obtenu par combustion du phosphore dans le
dioxygène : il se forme le décaoxyde de tétraphosphore, dont
l'hydratation donne l'acide orthophosphorique.
Equations de ces deux réactions :
4P + 5O2 = P4O10.
P4O10 + 6H2O
= 4H3PO4
Cet acide est obtenu industriellement par action de l'acide sulfurique
sur le phosphate de calcium.
Ca3(PO4)2+
3H2SO4 =2H3PO4
+3CaSO4
Une
partie de ces ions est oxydée en ions Fe3+
tandis que les ions nitrate sont réduits en monoxyde d'azote :
3Fe2+ = 3Fe3+
+3 e-.
NO3- + 4H+
+3 e- = NO+2H2O
NO3- + 4H+
+3Fe2+ = 3Fe3+ + NO+2H2O
(1)
Les ions Fe2+ restants sont ensuite dosés par
une solution de dichromate de potassium :
6Fe2+ = 6Fe3+
+6 e-.
Cr2O72-+
14H+ +6 e- = 2Cr3++7H2O
Cr2O72-+
14H+ +6Fe2+ = 6Fe3+
+2Cr3++7H2O (2)
concentration C2
des ions Fe2+ de la solution ainsi préparée : M(
sel de Mohr) = 391,85 g/mol
n(Fe2+) = m/M= 7,845 /391,85 =
0,02 mol dans 0,1 L soit C2 = 0,2 mol/L.
masse d'azote (m) contenue dans la solution
préparée :
n(Cr2O72-)
= V3C3 d'où n(Fe2+)
excès = 6 V3C3
d'après les coefficients de (2)
n(Fe2+) total
=V2C2 ; n(Fe2+)
réagit =V2C2-
6 V3C3 ;
n(NO3-) =
1/3 n(Fe2+) réagit
d'après les coefficients de (1)
masse d'azote : n(NO3-)
*14 = 14 / 3 (V2C2- 6 V3C3
) =4,67 (V2C2- 6 V3C3
)
m(azote) = 4,67 (10*0,2- 6 *7,4*0,01 )10-3=7,26
10-3 g dans 10 mL de la solution d'engrais
soit 7,26 10-2 dans 100 mL ou
dans 1,25 g d'engrais ou 7,26/1,25 = 5,8 %.
|
|
Problème
7 :
La décomposition par fermentation du sucre C6H12O6,
contenu dans le jus de raisin, donne de l'éthanol et du dioxyde de
carbone.
- Ecrire l'équation chimique de la réaction chimique
mise en jeu.
- Quelle est la quantité de matière (mol) d'éthanol
obtenue par la fermentation de 75 L de jus de raisin contenant 240 g de
sucre par litre ?
- Quel est le volume de dioxyde de carbone formé ( m3)
?
- Quel est le degré alcoolique du vin sachant qu'il
correspond au nombre de mL d'éthanol pur contenu dans 100 mL de vin ?
Le degré calculé ne reflète pas la réalité. En fait, on considère qu'il
faut 16,83 g de sucre pour obtenir 1 degré d'alcool.
- Calculer le degré alcoolique réellement obtenu après
fermentation du jus de raisin. Pouvez vous expliquer cette différence ?
Volume molaire Vm= 24 L/mol ; masse volumique de
l'éthanol r= 0,740 g/mL.
corrigé
La
décomposition par fermentation du sucre C6H12O6,
contenu dans le jus de raisin, donne de l'éthanol et du dioxyde de
carbone.
C6H12O6
= 2 CO2 + 2C2H5OH
quantité de matière (mol) d'éthanol
obtenue par la fermentation de 75 L de jus de raisin contenant 240 g de
sucre par litre :
masse de sucre : 240*75 = 18000 g
Masse molaire C6H12O6
: M= 6*12+12+6*16 = 180 g/mol
quantité de matière de sucre (mol) = mase (g) / masse
molaire (g/mol) = 18000/180 = 100 mol
d'après les coefficients stoechiomètriques de l'équation
: n( éthanol) = 2 n(sucre) = 200
mol.
volume de dioxyde de carbone formé :
d'après les coefficients stoechiomètriques de l'équation
: n( éthanol) = n(CO2) =200 mol
volume du gaz ( L) = quantité de matière (mol) * volume
molaire (L/mol) =200*24 = 4800 L = 4,8
m3.
degré alcoolique du vin :
masse d'éthanol (g) = masse molaire (g/mol) * quantité
de matière (mol) = 46*200 = 9200 g.
volume d'éthanol ( mL) = masse (g) / masse volumique (
g/mL) = 9200 / 0,74 = 12432 mL = 12,43 L
12,43 L d'alcool pur dans 75 L de vin soit 12,43 /75 =
165 mL d'alcool pur par L ou 16,5
°.
degré alcoolique réel :
240 g de sucre pour 1 L de vin soit 240/16,83 = 14,3°.
Une partie de l'alcool s'évapore lors de la fermentation.
|
|
Problème
8 :
Un amide N-substitué A, du type R-CO-NH-R1
a une masse molaire M=87 g/mol. Sa composition massique centésimale est
: C : 55,2 % ; H : 10,3 % ; O : 18,4 % ; N : 16,1 %.
- Déterminer la formule brute de A.
L'hydrolyse en milieu basique de A est réalisée en chauffant à reflux
le composé A en présence d'une solution d'hydroxyde de potassium. On
obtient deux composés organiques : un carboxylate de potassium B et une
amine primaire C.
- Ecrire la réaction de A avec la solution d'hydroxyde
de potassium.
- Sachant que B contient 34,9% de potassium en masse,
déterminer sa formule semi-développée. Nommer l'acide carboxylique B'
correspondant.
- En déduire la formule semi-développée de l'amine C et
la nommer.
- Donner la formule semi-développée de A.
K : 39,1 g/mol
corrigé
formule
brute de A : CxHyOzNt
12x / 55,2 = M/100 soit x = 0,87*55,2/12 = 4 ; y/10,3 =
M/100 soit y = 0,87*10,3 = 9
16z/18,4 = 0,87 soit z = 0,87*18,4/16 = 1 ; 14t / 16,1 =
0,87 soit t = 0,87*16,1/14 = 1
C4H9ON.
L'hydrolyse en milieu basique de A est réalisée en
chauffant à reflux le composé A en présence d'une solution d'hydroxyde
de potassium. On obtient deux composés organiques : un carboxylate de
potassium B et une amine primaire C.
R-CO-NH-R1 + K++HO-
= R-COO- + K++
R1-NH2.
B contient 34,9% de potassium en masse : MB
/ 100 = MK / 34,9 = 39,1 / 34,9 soit MB=
39,1/0,349 = 112 g/mol.
B est R-COO- + K+
; MB= MR +12+32+39,1 ; MR
= 28 ; on identifie R à CH3-CH2-
B est CH3-CH2-COO-
+ K+ : propanoate de potassium
B' est l'acide propanoïque : CH3-CH2-COOH
C est la méthylamine CH3-NH2.
A est le N-méthylpropanamide CH3-CH2
-CO-NH-CH3
|
|
Problème
9 :
Une phéromone est une substance qui, après avoir été
secrétée par un insecte, est perçue par un individu de la même espèce
chez lequel elle provoque une réaction comportementale.
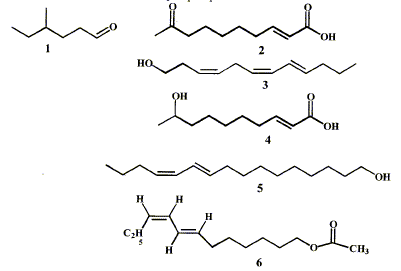
- Indiquer les groupes caractéristiques présents dans
les phéromones 2, 4, 6.
- Pour la phéromone 3 indiquer la nature Z ou E des
doubles liaisons.
- Nommer le composé 1.
- Le bombyx du murier détecte la phéromone émise 5, le
bombykol, par sa femelle dès qu'il y a plus de 192 molécules de
bombykol par mL d'air. Déterminer la concentration molaire puis
massique de cette phéromone correspondant au seuil de détection.
- La phéromone 1 peut être obtenue à partir de l'alcool
correspondant par une réaction d'oxydation par le permanganate de
potassium.
- Ecrire la formule de l'alcool et le nommer.
- Ecrire les équations d'oxydation en milieu acide ( couple MnO4-/Mn2+).
corrigé
groupes
caractéristiques présents dans les phéromones :
2 : cétone >C=O ; acide carboxylique -COOH ;
alcène >C=C<
4 : alcool secondaire C-OH ; acide carboxylique et alcène
6 : ester C-OCO-C et alcènes
Pour la phéromone 3 nature Z ou E des doubles
liaisons :
C4 C5 et C6
C7: Z ( les deux substituants sont du même côté
de la double liaison)
C8 C9 : E
( les deux substituants sont de part et d'autre de la double liaison)
Nom du composé 1 : 4-méthylhexanal (
aldehyde, le groupe >C=O est en bout de chaîne)
Le bombyx du murier détecte la phéromone émise 5, le
bombykol, par sa femelle dès qu'il y a plus de 192 molécules de
bombykol par mL d'air.
concentration molaire de cette phéromone
correspondant au seuil de détection :
192 000 molécules dans 1L d'air soit 192000/NA
= 192000 / 6,02 1023 = 3,2 10-19
mol/L d'air
Masse molaire du bombykol C16H30O
: M= 238 g/mol ;
concentration massique (g/L) = masse molaire (g/mol) *
concentration molaire (mol/L) = 238*3,2 10-19
=7,6 10-17 g/L.
La phéromone 1 peut être obtenue à partir de l'alcool
correspondant par une réaction d'oxydation par le permanganate de
potassium.
CH3-CH2-CH(CH3)-CH2-CH2-CH2OH
ou C7H16O :
4-méthylhexan-1-ol
5 fois {C7H16O=
C7H14O + 2H++2e-} oxydation en aldehyde
2 fois{
MnO4- +8H++5e-=
Mn2+ + 4H2O} réduction
bilan : 5C7H16O
+ 2MnO4- +6H+=
5C7H14O + 2Mn2+
+ 8H2O
|
|
retour
-menu
|


