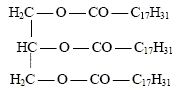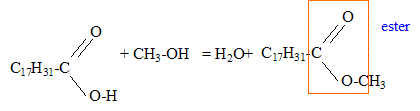|
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||||||||||||||||||||||||||||
| .
. |
|||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||
|
|
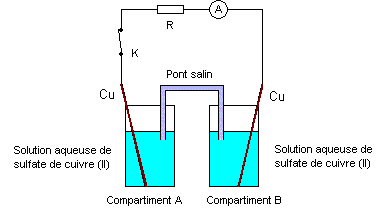
On se propose d’étudier un dispositif utilisé en électrométallurgie appelé « pile de concentration ». Cette pile est constituée de deux compartiments A et B reliés par un pont salin et contenant chacun une solution aqueuse de sulfate de cuivre (II) dans laquelle plonge une lame de cuivre. Les concentrations molaires volumiques dans les compartiments A et B pouvant prendre des valeurs égales ou différentes dans la suite de l’exercice. (schéma ci-dessous) 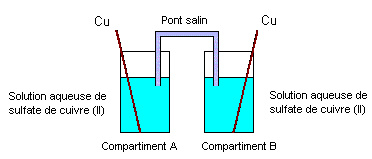
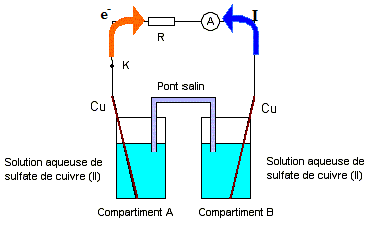
corrigé demi-équation associée au couple Cu2+/Cu : Cu2++ 2e- =Cu(s) Lorsque l’interrupteur K est ouvert, on fixe les
concentrations dans chaque compartiment : [Cu2+]A
= 10-2 mol./L et [Cu2+]B
= 1 mol./L. On ferme K et l’ampèremètre indique la circulation d’un
courant électrique. On observe également au bout de quelques minutes : réduction des ions Cu2+B
+ 2e- = CuB ; la
lame de cuivre B joue le rôle de cathode positive ( des électrons
arrivent)
équation de la réaction modélisant le fonctionnement de la pile : Cu2+B + CuA = Cu2+A + CuB Qr i= [Cu2+]A / [Cu2+]B = 0,01. On réalise une seconde expérience avec le même
dispositif, mais dont les concentrations sont telles que [Cu2+]A
= [Cu2+]B = 10-2
mol./L. A la fermeture de K on ne constate aucune circulation de
courant, ni aucune modification du système chimique. Qr éq s’identifie à la constante
d'équilibre K de la réaction de fonctionnement de la pile
|
||||||||||||||||||||||||||||||||
|
Données :
Tableau de miscibilité
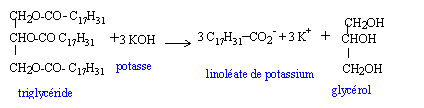
En 1987, la France a autorisé la fabrication de carburants d’origine agricole : les biocarburants. Ils sont destinés à être incorporés aux autres carburants. On trouve parmi ceux-ci les esters méthyliques d’huiles végétales : on les synthétise à partir d’huile de colza ou de tournesol et de méthanol. On se propose d’étudier ici une synthèse du linoléate de méthyle telle qu’elle est effectuée dans un laboratoire. Réactifs : - une masse m1 d’huile de colza que l’on considérera exclusivement constituée de trilinoléate de glycéryle. Dans les applications numériques, on prendra m1 =293 g ; - une masse m2 = 80 g de méthanol anhydre. - un catalyseur. Le mélange réactionnel est introduit dans un ballon, muni d’un agitateur magnétique et chauffé à reflux à 80°C pendant une heure. On sépare ensuite l’ester par décantation. Enfin ce dernier est purifié par distillation.
corrigé Obtention du linoléate de méthyle par une réaction d’estérification entre l’acide oléique de formule R-COOH ( avec R = C17H31 ) et le méthanol de formule CH3-OH.
La réaction du protocole du laboratoire correspond à un
autre mécanisme ; son bilan stoechiométrique est : Quantité de matière (mol) = masse (g) / masse molaire (g/mol) n(huile de colza ) = m1/M1 = 293 / 878 = 0,334 mol d'après les coefficients stoechiomètriques il faut 3*0,334 = 1 mol de méthanol masse (g) = quantité de matière (mol) * masse molaire (g/mol) m(méthanol) = 1*M2 =1*32 = 32 g. Or on a pris une masse m2 = 80 g
de méthanol anhydre : ce dernier est en excès ; l'huile de colza est en
défaut. à partir de 0,334 mol d'huile de colza ( réactif en défaut) on obtient 1 mol de linoléate de méthyle. m3 = 1* M3
= 1*294 = 294 g. méthanol ( en excès) ; glycérol ; linoléate de méthyle. Le glycérol, non miscible est éliminé par décantation. volume d’ester obtenu : volume (mL) = masse (g) / densité = 294/0,9 = 326,7 mL Le catalyseur doit être utilisé en faible quantité pour
éviter une réaction parasite : il contient des ions hydroxyde qui sont
susceptibles de réagir avec le trilinoléate de glycéryle.
|
|||||||||||||||||||||||||||||||||
|
|