|
Concours adjoint
technique de recherche et formation, préparateur en traitement des
matériaux
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
|
.
.
|
|
|
|
Questions
d'ordre général
: (
réponses écrites en bleu)
- Les rayons X sont arêtés par : les vétements, l'air, une feuille de plomb.
- Que désigne un picomètre ? un appareil de mesure de
longueur, un insecte, une
unité de mesure. 10-12
m = 1 pm.
- Quelle est l'unité de référence du Système
International pour les volumes ? cm3, litre, m3.
- L'air contient en volume : 78% de O2,
20 % de O2,
1% de O2.
- A quoi correspond un Pascal ? 1kgf, 1N / m², 1
bar.
- L'échelle de la maille élémentaire d'un cristal est
de l'ordre du millimètre, micromètre, nanomètre.
- Ecrire la correspondance en puissance de 10 : micro 10-6 ;
nano 10-9,
kilo 103,
giga 109.
- Le sodium appartient à la famille des halogènes, gaz
rares, alcalins.
- Que signifie ppm ? partie par million,
partie par milliard, partie par mille.
- Une eau est dite dure si elle contient beaucoup de calcaire,
soude, sel.
- Parmi les matériaux suivants, quels sont les
semi-conducteurs ? cuivre, silicium,
mylar, germanium,
bore, phosphore.
- Pour mesurer le diamètre d'une bille d'environ 3,15
mm vous utiliser une règle graduée, un
pied à coulisse, un décamètre, un palmer.
- La distance Terre Lune est proche de :280 000 km, 380 000 km,
530 000 km.
- Le rayon de la Terre est 6400
km, 4800 km, 8400 km.
- La charge d'un proton est égale en valeur absolue à
celle de l'électron. vrai
ou faux.
- Un anémomètre permet de mesurer le taux d'humidité ?
vrai faux. mesure
la vitesse du vent.
- Un hygromètre permet de mesurer la vitesse du vent ?
vrai ou faux. mesure
du taux d'humidité.
- La surface d'une sphère est 4/3 pr3. vrai faux.
- Le pgcd de 60,54, 24 vaut 6. vrai
faux.
- Deux isotopes ont le même numéro atomique. vrai faux.
- La glace est plus légère que l'eau. vrai faux.
- Une réaction exothermique dégage de la chaleur. vrai faux.
- Une colle epoxy est un polymère. vrai faux. un durcisseur
et une résine à mélanger.
- Donner les instruments qui permettent d'obtenir des
volumes avec précision : cuillère à soupe, burette,
bécher gradué, fiole jaugée,
erlenmeyer gradué.
- Les micas font partie des silicates,
carbonates, sulfates.
- Le granit est une roche effusive, intrusive, méthamorphique.
- L'épaisseur d'une lame pétrographique pour
l'observation au microscope polarisant est 30
mm, 300 m m, 3 m
m.
- Le jurassique est une période géologique qui
appartient à l'ère secondaire,
primaire, tertiaire.
- En partant du soleil, la 3ème planète du système
solaire est : Vénus, Terre,
Mars, Mercure. Mercure, Vénus, la Terre et Mars.
- Pour mesurer une différence de potentiel dans un
circuit, on place le voltmètre en série, en
dérivation.
- La capacité de stockage d'un disque dur se mesure en Gbyte,
Ghertz, Siemens, Pixels.
- La caréctistique principale d'une diode est : de ne laisser passer le courant que
dans un sens, de permettre le stockage des
charges, d'amplifier le courant.
- Parmi les éléments suivants, lequel n'est pas un
support de stockage d'informations: DVD, Modem,
CR Rom, Disquette.
- Parmi les instruments suivants, lequel permet de
mesurer l'acidité d'une solution ? spectrophotomètre, conductimètre, pHmètre,
ohmètre.
- Quelle est la charge d'un électron ? -1,6 10-19
C ; -1,6 1019 C ;+1,6 10-19
C.
- Le noyau de l'atome est constitué : de protons ; de
neutrons ; de protons et
de neutrons.
- Le nombre 50 est égale à : 0 ;
5 ; 1
; 10.
- Dans une solution solide Cu60-Zn40, les atomes de
zinc sont en site ? substitutionnel
; intersticiel.
- Quelles sont les liaisons constitutives d'un polymère
? métalliques ; ioniques ; covalentes.
- Quelle est la température de l'azote liquide ? -20 °C
; - 72 °C ; -196 °C.
- L'acide sulfurique a pour formule : H2SO4
; H2S ; SO3.
- Le symbole W est celui du : Afnium ; Tungstène ;
Vanadium ; Antimoine.
- Le symbole I est celui du : Indium ; Iridium ; Ytrium
; Iode.
- Sb est le symbole chimique : de
l'antimoine, du strontium, du soufre.
- La fonte est un alliage : de
fer et de carbone ; de fer et de chrome ; de fer
et de molybdène.
- Quels sont les constituants de base d'un polymère ? carbone-hydrogène
; carbone-silicium ; oxygène- azote.
- Dans un cristal de symétrie cristalline cubique : a =
b différent de c ; a= b = c
; les angles différent de 90 °.
|
|
Partie 2 : questions
pratiques.
- Citez trois applications utilisant un laser : bistouri en chirurgie, lecture d'un DVD,
alignement et niveau en construction, découpe industrielle.
- Comment évolue la résistance d'un conducteur
métallique avec la température ?
A une température donnée q, la résistance d'un conducteur métallique
s'exprime par : R = R0 (1+aq) avec a positif , q température en °C et R0,
résistance à °C. Donc R augmente avec la température.
- Par rapport aux propriétés électriques, quel est le
comportement d'un métal, d'un semi-conducteur et d'un isolant ? Donner
deux exemples pour chaque catégorie.
Les matériaux
semi-conducteurs ( silicium, germanium) présentent une conductivité
électrique intermédiaire entre les métaux et les isolants.
La résistivité r
( Wm) est une caractéristique électrique du
matériau.
Conducteur ( aluminium, cuivre , argent...) : r est inférieure à 10-5 Wm.
Isolant ( air, bois, plastiques, porcelaine...) : r est supérieure à 105 Wm.
- Quelles informations donnent un voltmètre, un
ampèremètre, un wattmètre ?
voltmètre
: mesure dune tenion électrique ; ampèremètre :
mesure l'intensité du courant ; wattmètre : mesure
la puissance électrique.
- Factoriser : 16 x²-25 = (4x+5)(4x-5).
- Combien pèse 12 mL
d'eau ( réponse en g)
1 L d'eau a une masse de
1kg = 1000 g ; 1 m L
d'eau a une masse de 10-3 g ; la masse de 12 m L est donc 12 10-3 g.
- Trouver l'arrondi de 115,020291 à 0,01 près par excès
: 115,02.
- Donner l'incertitude absolue Dy
en fonction de D a, D b, D
c pour y = a+b c.
On
pose bc = u ;
Dy = D a + D u
avec D
u / u = D b / b + D c / c soit D u = bc[ D b / b + D c / c].
- Compléter le schéma ci-dessous en plaçant au dessus
des flèches les mots qui correspondent aux changements d'états
physiques : fusion ; vaporisation; liquéfaction ; solidification ;
condensation ; sublimation.
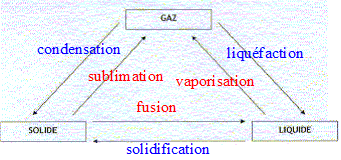
|
|
Partie
3 : exercices
 -
L'éprouvette ci contre est : un cube, une pyramide, un cylindre,
une sphère, un parallélépipède. -
L'éprouvette ci contre est : un cube, une pyramide, un cylindre,
une sphère, un parallélépipède.
- Calculer la hauteur de cette éprouvette et donner le résultat en cm
près par excès.
volume / aire de base =
6334 / 201 = 31,51 cm donc 32 cm.
- Sachant que la masse volumique de l'éprouvette est 7,82 g/cm3,
calculer la masse de l'éprouvette.
volume fois masse
volumique = 6334 *7,82 = 49,5 kg.
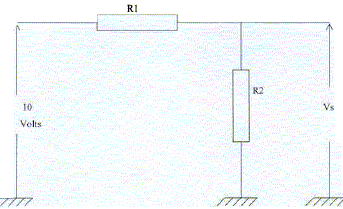 R1
= 2 kW ; R2
= 8 kW. R1
= 2 kW ; R2
= 8 kW.
- Quelle est la tension aux bornes de R1 ?
- Quelle est la tension Vs aux bornes de R2
?
- Quelle est l'intensité I du courant dans les résistances ?
Les résistances sont en série : 10 =
(R1+R2) I soit I= 10 / R1+R2)
= 10/10 = 1 mA.
Tension aux bornes de R1 : U1=R1I=
2*1 = 2 V ; tension Vs aux bornes de R2
: R2I = 8*1 = 8 V.
- L'ensemble des chercheurs de votre laboratoire
utilisent 22,5 g d'un produit X chaque semaine. Vous êtes chargé de
tenir et d'approvisionner ce produit en ayant 6 mois d'avance. Ce
produit est vendu en flacon de 100 g au prix de 179 euros HT. Combien
de flacons devez-vous commander et quel est le montant de la facture
TTC ?
6 mois correspondent à 26
semaines ; masse du produit consommé en 6 mois : 22,5*26 = 585 g.
Il faut commander 6 flacons ; prix HT : 6*179 = 1074 euros ; TVA à 19,6
% ; prix TTC : 1074*1,196 = 1284,5 euros.
- Préparation d'une solution d'1L d'acide chlorhydrique
molaire.
Il dispose d'un flacon contenant de l'acide chlorhydrique concentré
dont l'étiquette indique : densité d= 1,18 ; HCl 35 % ; masse molaire
M=36,46 g/mol
- Calculer le volume d'acide concentré à prélever.
masse d'acide pur dans 1 L
: 1,18*0,35 = 0,413 kg = 413 g ; quantité de matière (mol) =masse (g) /
masse molaire (g/mol) = 413/36,46 = 11,3 mol/L
Facteur de dilution F= 11,3 / 1 = 11,3 ; volume à prélever : 1 / 11,3 =
0,088 L = 88 mL
- On dose 20 mL de cet acide préparé par de la soude à 1 mol/L en
présence d'hélianthine. Le volume de soude NAOH à l'équivalence est 23
mL. Quelle est la concentration réelle de l'acide chlorhydrique ?
A l'équivalence CaVa
= CbVb soit Ca
= CbVb / Va
= 1*23/20 = 1,15 mol/L
- Action de l'acide chlorhydrique sur le fer : on verse quelques mL
d'acide chlorhydrique dilué sur de la limaille de fer déposée dans un
tube à essai. On observe un dégagement gazeux ainsi qu'une coloration
verdâtre de la solution. Que se passe-t-il dans le tube ?
oxydation du fer par
l'acide et dégagement de dihydrogène
Ecrire les équations chimiques de demi-réaction ainsi que l'équation
bilan de la réaction.
Fe = Fe2+
+ 2e- ; 2H+ + 2e-
= H2 ; Fe + 2H+ = Fe2+
+ H2
- Equilibrer les réactions d'oxydo-réduction suivantes :
MnO4- + 8H+ + 5e- = Mn2+
+ 4H2O.
2S2O32-
= S4O62-
+ 2e-.
Cr2O72-
+ 14 H+
+ 6e-
= 2Cr3+
+ 7H2O.
|
|
Pictogrammes

Donner la signification des pictogrammes.
corrigé
A:
irritant ou nocif ; B : Toxique ou très toxique ; C : dangers pour
l'environnement ; D : radioactivité ; E : risque biologique
F : risque d'explosions ; G : matières inflammables ; H
: matières corrosives ; I : danger électrique ; J : radiations non
ionisantes
K : risque d'asphixie; L : douche de sécurité ; M :
défense de fumer ; O : protection obligatoire de la vue ; P : sortie et
issue de secours
|
|
sécurité
- Citez les différentes voies de pénétration des
substances dangereuses dans l'organisme. Pour chque voie, quelle(s)
précaution(s) devez vous prendre pour vous en prémunir ?
Les trois voies de
pénétration d'une substance dangereuse dans l'organisme sont : contact
cutané (port de gants appropriés), ingestion (rare sauf accident),
inhalation (travail sous hotte aspirante).
- L'étiquette est la source d'information la plus
synthétique sur la dangerosité d'un produit. Nommer les trois
informations qui y figurent obligatoirement pour vous prévenir des
risques. ( pictogramme, phrases de
risques R ; phrases de sécurité S)
Quelle est la seconde source réglementaire d'information ?
- Quels sont les gestes à faire en cas de projection
d'acide concentré sur le corps ? Numéroter dans l'ordre les gestes
nécessaires.
essuyer (2); appeler
les pompiers (3);
rincer avec une solution de soude ; passer sous la douche (1) ; se déshabiller ; le
signaler au responsable hiérarchique (4).
- Les feux sont classés en 4 classes: A : feux de
solides ; B : feux de liquides ; C : feux de gaz ; D : feux de métaux.
On y ajoute les feux d'origine électrique E.
Dans le tableau suivant associer le ou les type(s) d'extincteurs
utilisable(s) pour un type de feu donné.
|
agents extincteurs
|
type de feux
|
|
A
|
B
|
C
|
D
|
E
|
|
eau pulvérisée
|
X
|
|
|
|
|
|
eau pulvérisée avec additif AFFF
|
X
|
X
|
|
|
|
|
poudre BC
|
X
|
X
|
X
|
|
|
|
poudre ABC
|
X
|
X
|
X
|
|
|
|
poudre spéciale
|
|
|
|
X
|
|
|
dioxyde de carbone CO2
|
|
|
X
|
|
X
|
- Vous devez installer un appareil électrique de
puissance 1,2 kW fonctionnant en 220 V. Vous avez à disposition les
fusibles suivants : 1 A, 3 A, 5 A, 10 A , 15 A. Quel fusible
utilisez-vous pour protéger l'installation ? Justifier.
intensité (A) = puissance
(W) / tension (V) = 1200/220 =5,45 A
La valeur du fusible doit être légèrement supérieure à l'intensité de
fonctionnement et la plus proche possible ( donc 5,5 A) : 10 A est bien
trop grand, à défaut 5 A serait la valeur la plus appropriée de la
liste.
|
|
retour
-menu
|


 -
L'éprouvette ci contre est : un cube, une pyramide, un cylindre,
une sphère, un parallélépipède.
-
L'éprouvette ci contre est : un cube, une pyramide, un cylindre,
une sphère, un parallélépipède. R1
= 2 kW ; R2
= 8 kW.
R1
= 2 kW ; R2
= 8 kW.