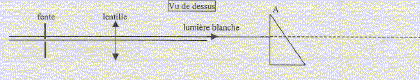|
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
||||||||||||||||||||||||||
| .
. |
||||||||||||||||||||||||||
|
||||||||||||||||||||||||||
|
|
Afin de déterminer la concentration totale en ion Fe3+
de l'échantillon de vin, les élèves réalisent une échelle de teinte de
concentrations différentes. Ces solutions aqueuses sont obtenues par
dilution d'une solution aqueuse de concentration connue en ion Fe3+.
Dans 10 mL de chaque solution aqueuse fille d'une part et dans 10 mL de
vin d'autre part seront introduits : Liste des solutions demandées par le professeur : 1 L de solution d'acide chlorhydrique à 1% en volume ; 1 L de solution aqueuse acide à 100 mg/L de fer III ; 500 mL de solution aqueuse de thiocyanate de potassium à 200 g/L ; 1 L de solution aqueuse de peroxyde d'hydrogène à 0,2 volume ; 1 L de vin blanc décoloré ; eau distillée. Les produits disponibles sont : alun de fer et d'ammonium (NH4)2, Fe2(SO4)3, 24 H2O M= 964,39 g/mol ; acide chlorhydrique concentré commercial à 35% d= 1,19 37% en masse pur M= 36,46 g/mol ; thiocyanate de potassium commercial M= 97,8 g/mol ; peroxyde d'hydrogène à 110 volumes d=1,11 ; 30% en, masse pure M= 34,01 g/mol. A- dosage colorimétrique :
ions présents dans l'acide chlorhydrique : ion chlorure Cl- et ion oxonium H3O+. le pictogramme signifie : corrosif, provoque des brûlures donc port de blouse, gants et lunette. concentration molaire de la solution aqueuse A d'acide commerciale : d= 1,19 signifie : 1 L a une masse de 1190 g et contient 37% en masse d'acide pur soit m = 1190*0,37 = 440,3 g Qté de matière (mol) = m/M = 440,3/ 36,46 = 12 mol dans 1 L. préparer 1 L de solution aqueuse B : facteur de dilution F= 100 ; CB= 12/F= 12/100 = 0,12 mol/L prélever 1000/F= 10 mL de solution du commerce à l'aide d'une pipette jaugée + pipeteur ; placer dans une fiole jaugée de 1L contenant un peu d'eau distillée ; compléter jusqu'au trait de jauge avec de l'eau distillée ; agiter pour rendre homogène. Port de blouse, gants, lunette et travail sous hotte. On choisit les cristaux d'alun de fer III et d'ammonium plutôt que les cristaux de chlorure de fer III : FeCl3 : irritant pour la peau, les yeux, les muqueuses, nocif par ingestion. masse de cristaux d'alun nécessaire à la préparation de la solution à 100 mg/L de fer III : n(Fe3+) = m/M= 0,1/55,8 = 1,79 10-3 mol or (NH4)2, Fe2(SO4)3, 24 H2O = 2NH4+ + 3SO42- + 2 Fe3+ donc n(alun) = 0,5* 1,79 10-3 = 8,96 10-4 mol masse d'alun : m =n M= 8,96 10-4 *964,39 =0,864 g. Pour chaque solution fille, volume de solution mère à prélever : solution n°1 : facteur de dilution F1= 100/1 = 100 ; volume pipette jaugée := volume fiole jaugée / F1 = 100 /100 = 1 mL solution n°2 : F2= 100/2 = 50 ; volume pipette jaugée = 100 / F2 = 100/50 = 2 mL puis 3 ; 4 ; 5 ; 6 ; 7 ; 8 ; 9 ; 10 mL. formule brute : H2O2 ; nom usuel : eau oxygénée ; Un comburant est un produit chimique qui permet la combustion d'un combustible ( exemple : le dioxygène de l'air) ; favorise l’inflammation des matières combustibles. précautions à prendre pour conserver
l'eau oxygénée : au froid et à l'abri de la lumière méthode ( produit chimique et verrerie )qui permet de vérifier la concentration : dosage : réaction d'oxydoréduction entre le peroxyde
d'hydrogène (eau oxygénée) H2O2
et l'ion permanganate MnO4-
: la solution titrante, de concentration connue est le permanganate de
potassium ( burette graduée, erlenmeyer,agitateur magnétique) ; l'ion
permanganate ( couleur violette) joue aussi le rôle d'indicateur de fin
de réaction. faccteur de dilution F = 110/0,2 =550 mL ; volume de solution mère à prélever ( pipette jaugée + pipeteur) : 1000/550 =1,8 mL ou bien par pesée : masse de H2O2 dans 1L de solution à 110 volumes : 1110 *0,30 = 333 g ; peser 333/F=333/550 = 0,60 g de solution mère. fiole jaugée de 1L et compléter avec de l'eau distillée
jusqu'au trait de jauge. formule du thiocyanate de potassium : KSCN signification de ce pictogramme : nocif, irritant gaz toxique qui peut ce dégager au contact d'un acide : HCN couleur de l'ion complexe obtenu en faisant réagir le thiocyanate de potassium sur une solution contenant l'ion fer III : rouge vif. Détermination qualitative de la concentration du vin en ion Fer III : comparer la couleur de la solution contenant le vin à l'échelle de teintes ; on essaye de situer la solution contenant le vin entre deux couleurs de l'échelle de teinte. l'absorbance A est directement acquise par le logiciel ; la concentration est saisie au clavier. possibilités offertes par le logiciel du type
tableur-traceur pour exploiter les résultats obtenus : régression
linéaire pour obtenir la fonction A= f(C)
|
|||||||||||||||||||||||||
|
On se propose de déterminer par différentes méthodes la vitesse de propagation des ultrasons de fréquence f
corrigé 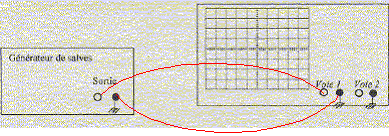
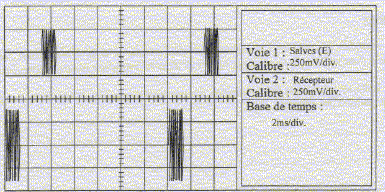
temps entre deux salves T1: 7 divisions soit 7*2 = 14 ms ; la durée d'une salve T2 : 1 division soit 1 ms. fonction du bouton "rapport cyclique" sur le générateur de salves : donne le rapport T1 /T2 ou l'inverse. réglage de l'oscilloscope a été modifié entre les oscillogrammes des figures 1 et 2 : sensibilité horizontale ( on a remplacé 2 ms/div par 10 ms/div ) période T des ondes ultrasonores : 2,5 div soit 2,5*10 = 25 ms = 2,5 10-5 s. valeur de la fréquence f = 1/T = 1/2,5 10-5 = 40 000 Hz. Cette fréquence n'est pas audible pour l'oreille humaine, elle se situe en dehors de l'intervalle audible de cette oreille [20 - 20 000 Hz] les branchements à réaliser entre le générateur de salves, l'émetteur, le récepteur, l'oscilloscope :
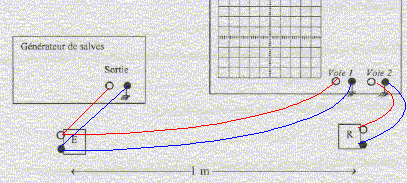
signal correspondant à l'émetteur : celui de la partie inférieur de l'écran de l'oscilloscope : ce signal est en avance sur le signal reçu par le récepteur synchronisation de l'oscilloscope : voie 1, signal
émetteur. célérité du son dans l'air : d/Dt= 1/3,2 10-3 = 312 m/sou 312*3,6 =1125 km/h. la vitesse du son dans l'air augmente quand la température augmente. cair = (331,5 + 0,6·q) ; q température en Celcius position du dispositif permettant
d'émettre le "clap" en fonction des positions des micros : placé ce
dispositif entre les deux micros de telle manière que la distance [
dispositif- micro n°1] - distance [dispositif - micro n°2] soit égale à
d= 1 m. A défaut de ce type d'oscilloscope, système d'acquistion + ordinateur + interface. |
||||||||||||||||||||||||||
|
On éclaire une fente verticale avec une lampe à incandescence et on réalise l'image du filament sur un écran.
corrigé dispositif à intercaler entre la fente et la lampe afin d'avoir le maximum d'intensité lumineuse dans la fente : condenseur ou lentille suffisamment convergente pour faire converger la lumière issue de la source au centre de fente. lentille à utiliser pour réaliser l'image de la fente sur l'écran : lentille mince convergente. Une lentille convergente à les bords plus minces que la partie centrale ; une lentille divergente à les bords plus épais que la partie centrale. distance focale f ' de la lentille : si l'objet (la fente) est situé dans le plan focal objet, alors l'image donnée par la lentille se trouve à l'infini ; donc f '= 0,2 m ; vergence v= 1/f = 1/0,2 = 5 d. modifier la position de la lentille pour avoir une image nette de la fente sur l'écran : rapprocher la lentille de l'objet, la fente. formule de conjugaison : ( on écrit en bleu les grandeurs algèbriques) : 1/f ' = 1/OA'-1/OA. avec 1/f = 1/0,2 = 5 et OA
= -0,22 m ; 1/OA'
= 5 -1/0,22 = 0,454 ; OA'
= 2,2 m.
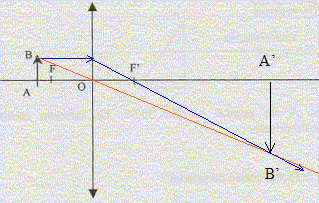
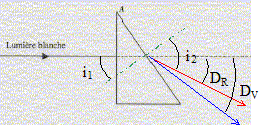
l'angle d'incidence i1 vaut 30° ( des angles A et i1 à cotés perpendiculaires ont même mesure) seconde loi de Descartes pour la réfraction de la
lumière rouge : nR sin i1
=nair sin i2. de même pour le violet : sin i2V = nV sin i1 =1,673 sin 30 = 0,836 ; i2V = 56,8° la déviation est la plus importante pour le violet. La relation de Cauchy est compatible avec les indices nR et nV car l'indice est d'autant plus grand que la longueur d'onde est plus petite ( lR>lV) Le spectre de la lumière blanche est un spectre continu d'émission. appareil permettant de réaliser des mesures précises de
longueur d'onde en utilisant un prisme : spectromètre
|
||||||||||||||||||||||||||
|
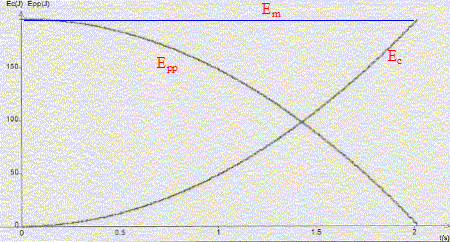
On désire étudier la chute des corps dans le champ de pesanteur terrestre . g = 9,81 m/s².
corrigé Dans l'air pour une bille d'acier ( objet dense de petite dimension) durant les deux premières secondes de chute, celle-ci peut être considérée comme une chute libre. Les frottements sur les couches d'air peuvent être négligés. la seconde loi de Newton : la somme vectorielle des forces appliquées au solide est égal au produit de la masse du solide par l'accélération du centre de gravité du solide. Pour unse chute libre ( objet soumis uniquement à son poids) ma= mg ( les vecteurs sont écrits en bleu) soit a= g vitesse instantanée : v =( Dt+Dt - Dt)/Dt avec Dt le plus petit possible. hauteur de chute en fonction de z et z0 : h = z0-z. Linéariser v = (2gh)½
: v² = 2gh ; représenter v² en fonction de h ; v² en ordonnée ; droite
de pente "2g" v s'exprime en m s-1 ; g s'exprime en m s-2 et h en m soit gh en m2s-2 et (gh)½ en ms-1. La vitesse est indépendante de la masse du corps. L'énergie cinétique est proportionnelle à la masse : Ec =½mv² ; Epp= mgh ; Em =½mv² + mgh.
Em = constante pour une chute libre ; Em diminue dans une chute réelle ( frottements sur les couches d'air).
|
||||||||||||||||||||||||||
|
|
 Que
signifie t-il ? Quels dangers présente la manipulation de cet acide ?
Que
signifie t-il ? Quels dangers présente la manipulation de cet acide ? . Quelle
est la signification de ce pictogramme ?
. Quelle
est la signification de ce pictogramme ?


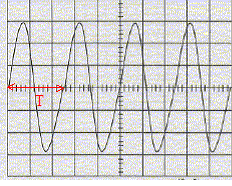 10 ms/div
10 ms/div