|
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||||||||||||||||||||||||
| .
. |
|||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||
|
|
Données : H: 1,00 ; N : 14,0 g/mol ; Ka = 6,3 10-10 ; pKa = 9,2 ; aide aux calculs : 1,6,3 = 0,16 ; 10,8*17,0=184 ; 184/920 = 2,00 10-1. Sur l'étiquette d'une solution commerciale d'ammoniac ( NH3) on lit : % massique en ammoniac : 20 %. On prépare 100 mL d'une solution diluée, noté S au 20ème de la solution commerciale , notée S0.
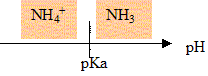
l'espéce " acide conjugué "de l'ammoniac est l'ion ammonium NH4+. couple acide base : NH4+ / NH3.
L'espèce
NH3 prédomine dans la solution S ( pH>pKa)
K= [NH4+]/([H3O+][NH3]) = 1/Ka = 109,2 ; K est très grand, la transformation est totale. concentration molaire C de la solution S : à l'équivalence les réactifs mis en présence sont en proportions stoechiométriques : C V= CA VA éq C = CA VA éq /V = 0,5*10,8 / 10 = 5,4 10-1 mol/L. concentration C0 de la solution commerciale : C0 = 20 C = 10,8 mol/L expression du pourcentage massique de la solution : masse d'ammoniac pure dans 1 L : C0M avec M : masse molaire ammoniac ( g/L) masse de 1 L de solution : m
g ; %massique d'ammoniac p%= C0M*100 / m = 10,8*17*100/920 = 20 %,
valeur en accord avec l'indication de l'étiquette.
n1 =VC= 10 10-3*0,54 = 5,4 10-3 mol ; n2=CAVA= 0,5*6 10-3 = 3 10-3 mol
3 10-3-xfin = 10-pH * (10+6) 10-3= 1,6 10-11 mol soit xfin = 3 10-3 mol taux d'avancement final t = xfin / xmax = 1 ; la transformation est totale.
|
||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||
|
|