|
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|
| .
. |
|
|
|
|
A un instant choisi comme origine des dates, un plongeur de masse m=67,5 kg, s'élance de son plongeoir depuis le point O avec une vitesse initiale v0 = 5 m/s, incliné de a=30° par rapport à l'horizontale. Le plongeoir est situé à une hauteur h=8 m au dessus de la surface de l'eau. 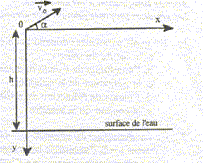
corrigé équation de la trajectoire dans le repère indiqué : accélération : (0; g) vitesse , primitive de l'accélération : ( v0cosa ; gt - v0 sin a ) position, primitive de la vitesse : x= v0cosa t ; y = ½gt²- v0 sin at . t = x/( v0cosa) ; repport dans l'expression de y : y= ½gx²/(v0cosa)² - x tan a. y= 4,9 x²/(5 cos 30)² - x tan30 = 0,261 x²-0,577 x. durée écoulée entre l'instant où le plongeur quitte le point O et le moment où il entre dans l'eau : résoudre y= 8 soit : 8=4,9 t²-2,5 t ; 4,9 t²-2,5 t-8=0 ; t = 1,56 s. coordonnées du point où le plongeur touche l'eau : x= v0cosa t= 5 cos30*1,56 = 6,75 m y = ½gt²- v0 sin at = 4,9*1,56²-5 sin30*1,56 = 8 m. valeur de la vitesse du plongeur au moment où il touche l'eau : vx= v0cosa = 5 cos30 =4,33 ; vy= gt - v0 sin a = 9,8*1,56 -5 sin30 = 12,8 m/s v² = v²x+v²y=4,33² + 12,8² = 182,6 ; v = 13,5 m/s.
|
|
|
Dans une centrale nucléaire, une des réactions possibles est représentée par : 23592U+ 10n---> 9438Sr+ 139xXe+y 10n
corrigé 23592U+ 10n---> 9438Sr+ 139xXe+y 10n lois de conservation : conservation de la charge : 92 = x+38 soit x=54 conservation du nombre de nucléons : 235+1=94+139+y soit y=3 énergie libérée par la réaction d'un atome d'uranium 235 : Dm= m(9438Sr) + m(139xXe) + 3 m(neutron) -m(23592U) = 93,8946 + 138,8882 +2*1,0087- 235,0134 = -0,2132 u puis -0,2132 *1,66 10-27 = 3,54 10-28 kg E= |Dm|c² = 3,54 10-28*(3108)² =3,185 10-11 J ou 3,185 10-11 /1,6 10-19 = 1,99 108 eV= 199 MeV activité de 1,0 g d'uranium 235 : A= l N N= masse / masse molaire * NA= 1/235*6,02 1023 =2,56 1021 noyaux d'uranium 235 dans 1 g. lt½=ln2 soit l =ln2 / t½=ln2 / (4,5 109*365*24*3600) =4,88 10-18 s-1. A= l N = 4,88 10-18 *2,56 1021=1,25 104 Bq.
|
|
|
Parmi les constituants du lait, le lactose est l'un des principaux glucides. Ce dernier en présence de bactérie, se dégrade et se transforme en acide lactique de formule semi-développée CH3-CHOH-COOH. La teneur en acide lactique d'un lait est un critère de fraicheur. Si la teneur dépasse 5,0 g/L, le lait caille. Pour un lait frais cette teneur se situe autour de 1,8 g/L. On donne la masse molaire de l'acide lactique M= 90,0 g/mol. On dose un volume V= 20 mL de lait par une solution d'hydroxyde de sodium de concentration cb=0,10 mol/L. Le volume équivalent est obtenu pour véq = 8,5 mL d'hydroxyde de sodium versé.
corrigé base conjuguée de l'acide lactique : CH3-CHOH-COO- équation de la réaction de l'acide lactique avec l'hydroxyde de sodium : CH3-CHOH-COOH + HO- =CH3-CHOH-COO- + H2O concentration molaire de l'acide lactique : à l'équivalence du titrage cbvéq= V C soit C= cbvéq/ V=0,1*8,5 / 20 = 0,0425 mol/L (0,042 mol/L) titre massique (g/L) = concentration molaire ( mol/L) * masse molaire (g/mol) = 0,0425*90 = 3,8 g/L valeur supérieure à 1,8 g/L, ce lait n'est pas consommable ; de plus il est caillé. indicateur le plus adapté : à
l'équivalence la solution contient une base, l'ion lactate CH3-CHOH-COO-
: le pH du milieu est supérieur à 7.
|
|
|
On réalise la réaction d'oxydation des ions iodure I-(aq) par une solution d'eau oxygénée. Les couples mis en jeu sont : I2(aq) /I- (aq) ; H2O2/H2O. 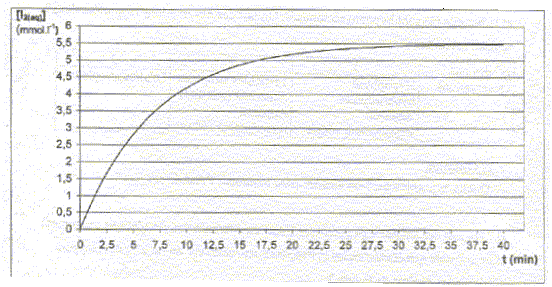
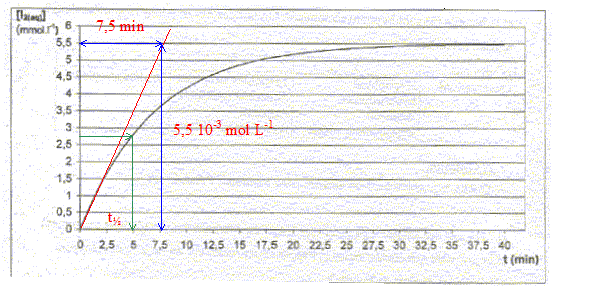
corrigé demi-équations et l'équation bilan de la réaction : 2I- = I2 + 2e- oxydation ; H2O2+ 2H+ + 2e- = 2H2O réduction H2O2+ 2H+ +2I- = I2 +2H2O vitesse volumique de réaction : v= 1/V dx/dt avec x : avancement en mol et V : volume de la solution (L) si V est constant v = d[I2]/dt graphiquement, coefficient directeur de la tangente à la courbe ci-dessus, à la date considérée.
v 0=( d[I2]/dt)0 = 5,5 10-3 / 7,5 = 7,3 10-4 mol L-1 min-1. Evolution de la vitesse de la réaction : La vitesse de la réaction diminue au cours du temps, car les concentrations des réactifs diminuent : la concentration des réactifs est un facteur cinétique. Graphiquement les tangentes à la courbe ci-dessus se rapprochent de l'horizontale, au cours du temps. temps de demi-réaction t½ : durée au bout de laquelle l'avancement est égal à la moitié de l'avancement final : lecture graphe t½ = 5 min.
|
|
|
|