|
d'après concours manipulateur électroradiologie médicale AP Paris, Nantes, Rennes En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
| .
. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
I- Réalisation de la pile : On réalise une pile à partir des couples Pb2+(aq) / Pb(s) et Sn2+(aq)/Sn(s). Les ions Pb2+(aq) proviennent d'une solution de nitrate de plomb( Pb2+(aq)+2NO3-(aq)), les ions Sn2+(aq) proviennent d'une solution de nitrate d'étain ( Sn2+(aq) +2NO3-(aq)). La demi-pile de gauche contient le métal étain plongeant dans une solution de volume V2 = 30,0 mL, C2= 2,0 10-2 mol/L. La demi-pile de droite contient le métal plomb plongeant dans une solution de volume V1= 20 mL, C1 = 3,0 10-2 mol/L. Le pont salin est réalisé avec du nitrate de potassium. M(Pb)= 207,2 ; M(Sn)=118,7 g/mol ; e = 1,6 10-19 C ; NA= 6,02 1023 mol-1 ; Pb2+(aq) + Sn(s) = Sn2+(aq)+ Pb(s). K1= 2,18 Sn2+(aq)+ Pb(s) = Pb2+(aq) + Sn(s) ; K2 = 0,46. L'électrode positive de cette pile est l'électrode de plomb.
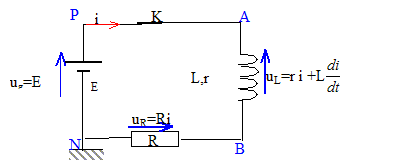
II. Circuit RL : on remplace la pile maison par un générateur de tension stabilisée de fem E=1,5 V. Le montage électrique consiste en une association série d'une bobine réelle (L ; r= 8,6 W), d'un conducteur ohmique (R=10 W ), d'un interrupteur et du générateur.
corrigé 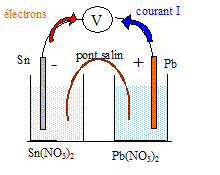
Sn (s ) = Sn2+(aq)+ 2e- : oxydation du réducteur l'étain. Pb2+(aq) +2e-=Pb (s ) réduction de l'oxydant Pb2+(aq) Sn (s ) + Pb2+(aq) = Sn2+(aq) + Pb (s ) Dans la solution et dans le pont salin, les cations positifs se déplacent dans le sens conventionnel du courant, tandis que les anions négatifs se déplacent en sens contraire. utilité du pont salin : assure la continuité électrique et assure l'électroneutralité des solutions. variation de masse de l'électrode de plomb : augmentation de masse Q=It= 0,015*2*3600 = 108 C soit n(e-) = 108/96500 = 1,12 10-3 mol d'électrons. or Pb2+(aq) +2e-=Pb (s ) d'où n(Pb)= ½n(e-) =5,6 10-4 mol masse de plomb correspondante (g) = n(Pb) M( Pb) = 5,6 10-4
*207,2 = 1,16 10-1 g ( 0,12 g)
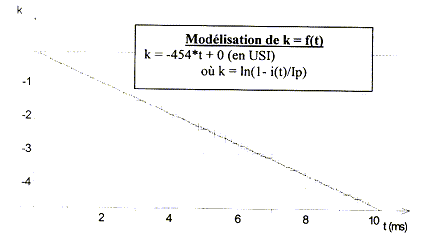
valeur de la constante de temps : d'une part i=IP(1-exp(-t/t)) soit i/IP = 1-exp(-t/t) d'autre part k = ln(1-i/IP) = ln(exp(-t/t)) = -t/t = -454 t d'où t = 1/454 = 2,20 10-3 s. valeur de l'inductance de la bobine :t = L/(R+r) soit L= t (R+r) = 2,20 10-3 *18,6 = 4,1 10-2 H. la constante de temps est homogène à un temps exprimé en seconde : t = L/(R+r) ½LI² a la dimension d'une énergie en J ; L a la dimension d'uné énergie divisée par une intensité au carré : J A-2. (R+r) I² t a la dimension d'une énergie soit (R+r) a la dimension d'uné énergie divisée par une intensité au carré, divisée par un temps : J A-2 s-1. donc L/(R+r) a la dimension d'un temps. équation différentielle traduisant l'évolution temporelle du courant i(t) : ug = uL+uR ; E= ri+Ldi/dt+Ri Ldi/dt + (R+r)i = E soit di/dt = E/L-(R+r)/L i = E/L-454 i= 36,59-454 i compléter le tableau : i(10-3) =i(5 10-4) + Di(tn) = i(5 10-4) + (di/dt)5 10-4Dt = 0,018+28,29*5 10-4 = 0,0321 A (di/dt) 10-3=36,59-454 *0,0321=21,99. i(1,5 10-3) =i(1 10-3) + Di(tn) = i(1 10-3) + (di/dt) 10-3Dt = 0,0321+21,99*5 10-4 = 0,0431 A (di/dt) 1,5 10-3=36,59-454 *0,0431=17,02. i(2 10-3) =i(1,5 10-3) + Di(tn) = i(1,5 10-3) + (di/dt) 1,5 10-3Dt = 0,0431+17,02*5 10-4 = 0,0516 A (di/dt) 1,5 10-3=36,59-454 *0,0516=13,16.
avec un pas plus petit on augmente la précision, mais on multiplie le nombre de calculs.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Electrolyse : On envisage de chromer ( Cr) entièrement un pare-chocs métallique en y déposant une couche de chrome, d'une épaiseur e=50 mm. Le parre-chocs est considéré comme un bloc parallèlépipédique de longueur L= 2,0 m, de largeur l=0,10 m, de hauteur h= 5,0 mm. On plonge le parre-chocs dans une solution contenant des ions chrome III Cr3+, puis on électrolyse cette solution, entre l'électrode constituée par le parre-chocs et une seconde électrode de nature adéquate. L'opération dure 10 heures et son rendement est 95%.
corrigé équation de la réaction d'électrode qui permet la formation du chrome métallique à partir des ions chrome III : Cr3+(aq) + 3e- = Cr(s) , réduction à la cathode négative volume de la couche de chrome à déposer : surface du bloc : 2(L+l)h+2Ll = 2*210*0,5+2*200*10 =210+4000=4210 cm² v= e *surface du bloc =50 10-4 * 4210= 21 cm3. masse de chrome : r v = 7,2*21 = 151,6 g Qté de matière (mol) : n(Cr) = m/M= 151,6/52 = 2,92 mol donc d'après les coefficients de l'équation ci-dessus : n(e-) = 3 n(Cr) = 8,75 mol quantité d'électricité Q qui a traversé l'électrolyseur : Q= 96500 n(e-) = 96500*8,75 = 8,44 105 C de plus Q= It soit I = Q/t = 8,44 105 /(10*3600) = 23,4 A en tenant compte du rendement électrolytique : 23,4/0,95 = 24,7 A.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|