corrigé
demi-équations
et l'équation bilan de la réaction :
2I- = I2
+ 2e- oxydation ; H2O2+
2H+ + 2e- = 2H2O réduction
H2O2+
2H+ +2I- = I2
+2H2O
vitesse volumique de réaction : v= 1/V dx/dt avec x : avancement en mol
et V : volume de la solution (L)
si V est
constant v = d[I2]/dt
graphiquement,
coefficient directeur de la tangente à la courbe ci-dessus, à la date
considérée.
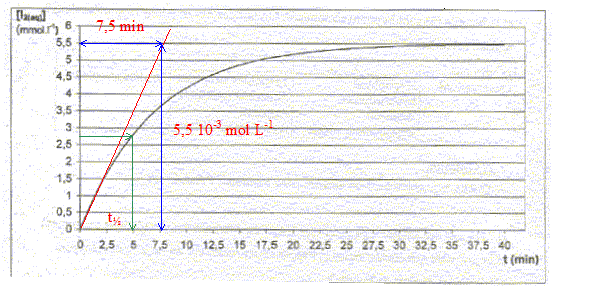
v 0=(
d[I2]/dt)0
= 5,5 10-3 / 7,5 = 7,3 10-4
mol L-1 min-1.
Evolution de la vitesse de la réaction :
La vitesse de
la réaction diminue au cours du temps, car les concentrations des
réactifs diminuent : la concentration des réactifs est un facteur
cinétique. Graphiquement les tangentes à la courbe ci-dessus se
rapprochent de l'horizontale, au cours du temps.
temps de demi-réaction t½ : durée au bout de laquelle l'avancement
est égal à la moitié de l'avancement final : lecture graphe t½ = 5 min.