|
Noms et formules des produits chimiques
:
|
formule
|
nom
|
|
C6H6
|
benzène
|
|
MnO2
|
dioxyde de manganèse
|
|
NaHCO3
|
hydrogénocarbonate de sodium
|
|
H2O2
|
peroxyde
d'hydrogène
|
|
NH4NO3
|
nitrate
d'ammonium
|
|
C2H2O4
|
acide oxalique
|
|
CH3-CH2-COO-CH3
|
propanoate
de méthyle
|
|
S2O32-
|
ion thiosulfate
|
Solution de sel de Mohr : FeSO4,
(NH4)2SO4,
6H2O
Identifier les ions présents et compléter le tableau
ci-dessous, en indiquant pour chacun d'eux, son nom, sa formule, le nom
du réactif permettant de le caractèrisé et le résultat obtenu si l'ion
est présent.
|
formule de l'ion
|
nom de l'ion
|
réactif
|
résultat
|
|
Fe2+
|
fer II
|
soude NaOH
|
Fe(OH)2 solide vert
|
|
SO42-
|
sulfate
|
BaCl2
|
BaSO4 solide blanc
|
|
NH4+
|
ammonium
|
chauffage en présence d'une base
|
dégagement NH3
|
Calculer la masse molaire du sel de Mohr. Fe : 55,8 ; S : 32,1 ; N : 14
; H : 1 ; O : 16 g/mol
FeSO4,
(NH4)2SO4,
6H2O : M= 55,8+2(32,1+64)+ 2(14+4) +6*18 = 392
g/mol
On désire préparer V1 =1 L d'une
solution aqueuse (S0) de sel de Mohr de
concentration c0 =0,2 mol/L. Décrire le mode
opératoire en précisant la verrerie utilisée.
Quantité de
matière (mol) = concentration (mol/L) * volume de la solution (L) =
0,2*1 = 0,2 mol
masse (g) = quantité
de matière (mol) * masse molaire (g/mol) = 0,2*392 =78,4 g.
Peser 78,2 g (balance
de précision, coupelle, spatule)
Dissoudre dans de
l'eau distillée dans une fiole jaugée de 1L
compléter avec de
l'eau distillée jusqu'au trait de jauge, agiter pour rendre homogène.
On doit préparer à
partir de la solution précédente, 200 mL d'une solution S1
de sel de Mohr à la concentration c1 = 0,01
mol/L. Décrire le mode opératoire en précisant la
verrerie utilisée.
facteur de
dilution F = c0/c1 = 0,2
/ 0,01 = 20
volume de la pipette
jaugée = 200 / F = 200 / 20 = 10 mL
Prélever 10 mL (
pipette jaugée + pipeteur) de solution mère S0 ;
placer dans la fiole jaugée de 200 mL ; compléter avec de l'eau
distillée jusqu'au trait de jauge, agiter pour rendre homogène.
Synthèse de l'arôme de
jasmin :
Cette synthèse peut être réaliser par chauffage à reflux
d'un mélange d'acide acétique et d'alcool benzylique. Donner la liste
du matériel à utiliser pour réaliser cette synthèse.
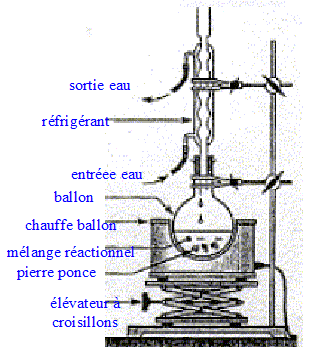
Sur les étiquettes des flacons des réactifs on
trouve les pictogrammes suivants :   Indiquer les précautions à prendre lors de la
manipulation de ces réactifs. Indiquer les précautions à prendre lors de la
manipulation de ces réactifs.
produits
toxiques, iriitants et corrosifs : travail sous hotte, port de blouse,
gants, lunette.
Le protocole
expérimental prévoit l'utilisation de 30 mL d'acide éthanoïque et de
20,5 g d'alcool benzylique ( r
= 1,05 g/mL). Calculer le volume d'alcool à prélever.
20,5 / 1,05 =
19,5 mL
A la fin de cette
synthèse, le milieu réactionnel est constitué de deux phases. Quel
matériel peut-on utiliser pour les séparer ?
ampoule à
décanter
Ultrasons :
Un émetteur d'ultrasons émet des ondes de fréquence 40
kHz.
- Déterminer la longueur d'onde l
dans l'air ( célérité : 340 m/s)
l = c/f = 340/40000 = 8,5 10-3
m = 8,5 mm.
- Lémetteur placé devant un mur émet perpendiculairement
à ce mur. Le récepteur placé juste à côté de l'émetteur, capte l'écho 3
ms plus tard. Calculer la distance séparant le mur de l'émetteur.
aller + retour =
2 aller ou 2 retour = célérité * durée = 340*3 10-3
= 1,02 m ; distance mur- émetteur 0,51 m
Optique
:
Une lentille porte sur sa monture l'indication -5 d. Que représente cette valeur ?
Quelle est l'unité correspondante ?
vergnec e
exprimée en dioptries.
En déduire la nature de cette lentille et calculer sa
distance focale.
Une lentille
divergente a un
vergence négative ; distance focale f ' = -1/5 = -0,2 m.
Compléter le schéma ci-dessous :
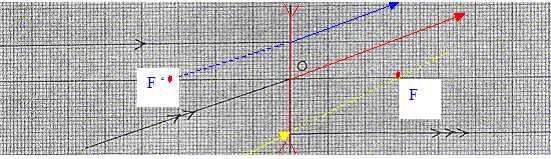
Un professeur veut illustrer le phénomène de réflexion
totale. Quelle expérience proposée ?
source de
lumière ( fente) + bloc de plexiglass. Etude du passage du faisceau
lumineux du plexiglass dans l'air ( milieu moin réfringent ). Faire
tourner ce bloc afin que seul subsiste le rayon réfléchi.
n
sin i1 = sin i2 ; sin i2
= 1,5 sin 30 = 0,75 soit i2 = 48,6°.
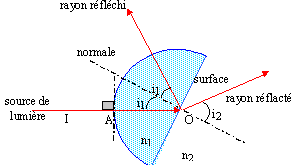
réflexion
totale :
Quelle
est la valeur maximale de i1 telle que le rayon
réfracté n'existe plus ?
|sin
i2 | inférieur ou égal à 1 soit n |sin i1c|
<=1
|sin
i1c| <= 1/n soit |sin i1c|
<= 0,666 soit i1c <= 41,8°.
électricité :
- Tension redressée : sur l'écran
d'un oscilloscope on visualise l'oscillogramma ci-dessous ( 0,1 ms/div
et 0,2 V/div)
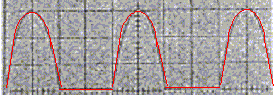
- Donner la liste du matériel nécessaire pour
réaliser cette expérience.
générateur
basse fréquence ou transformateur 220V / 6 V, oscilloscope, diode,
résistor de protection de la diode
- Dessiner le
schéma du montage :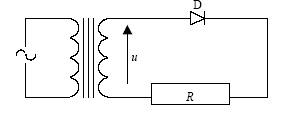
l'oscilloscope
est monté en dérivation aux bornes du résistor R.
- Déterminer
graphiquement la période, la fréquance et l'amplitude de cette tension.
période T :
4 div soit 0,4 ms = 4 10-4 s ; fréquence f= 1/T=
2500 Hz ; amplitude : 3 div soit 0,6 V.
- Quel composant
faudrait-il changer dans le montage pour obtenir un redressement double
alternance ? Donner son nom. Indiquer brièvement comment il est
constitué.
la diode
doit être remplacée par un pont redresseur de Graetz 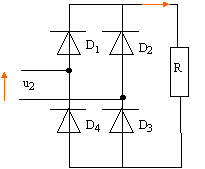
- Utilisation d'une lampe : une
petite lampe porte sur son culot les indications suivantes : 6 V - 3 W
- Calculer l'intensité du courant électrique qui la traverse.
P= UI soit
I= P/U = 3/6 = 0,5 A
- En assimilant
cette lampe à un conducteur ohmique, déterminer sa résistance dans les
conditions de fonctionnement ci-dessus. Avec quel appareil pourrait-on
vérifier le résultat trouvé ? Décrire la méthode utilisée.
U= RI soit
R= U/I = 6/0,5 = 12 W
; ohmètre branché aux bornes de la lampe lorsque celle-ci ne fait pas
partie d'un circuit traversé par un courant.
- Cette lampe est
traversé par un courant de 0,25 A et la tension à ses bornes est 1,7 V.
La lampe brille-t-elle normalement ? Pourquoi ?
puissance
absorbée par la lampe ; 1,7*0,25 = 0,42 W ; la lampe brille très peu,
elle ne fonctionne pas dans les conditions nominales ( 6V à ses bornes)
cocher les cases convenables du tableau
suivant en précisant les caractéristiques des différents supports
informatiques :
|
possibilité d'effacer des données
|
capacité de stockage supérieure à 1 giga
octets
|
nécessité d'un lecteur spécifique
|
peut transmettre un virus
|
coût < 15 euros
|
|
disquette
|
x
|
|
x
|
x
|
x
|
|
disque dur de l'ordinateur
|
x
|
x
|
|
x
|
|
|
CR-rom
|
|
|
x
|
x
|
x
|
|
CR-rom réinscriptible
|
x
|
|
x
|
x
|
x
|
|
cartouche Zip
|
x
|
x
|
x
|
x
|
x
|
|
disque dur USB amovible
|
x
|
x
|
|
x
|
|
|



 Indiquer les précautions à prendre lors de la
manipulation de ces réactifs.
Indiquer les précautions à prendre lors de la
manipulation de ces réactifs.


