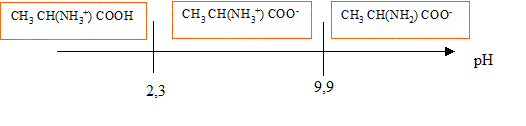|
concours inspection des fraudes En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
||
| .
. |
||
|
||
|
|
L’alanine a pour formule chimique CH3 CH(NH2) COOH. Ce composé existe à l’état solide et en solution aqueuse sous la forme d’un amphion ou ion dipolaire ou zwittérion de formule chimique CH3 CH(NH3+) COO-.
corrigé Dans la molécule d'alanine on trouve deux fonctions chimiques : une fonction amine -NH2 au caractère basique et une fonction acide carboxylique, au caractère acide. Base conjuguée de l’amphion : CH3 CH(NH2) COO- ; acide conjugué de l’amphion : CH3 CH(NH3+) COOH Les couples acide base sont : CH3 CH(NH3+) COOH / CH3 CH(NH3+) COO- pKa1 = 2,3 CH3 CH(NH3+) COO- / CH3 CH(NH2) COO- pKa2 = 9,9.
Lorsqu'on dissout de l'alanine dans l'eau, elle est essentiellement sous forme d'ion dipolaire -OOC-RCH-NH3+,( du fait de la forte solubilité dans l'eau) la concentration en molécules HOOC-RCH-NH2 est négligeable. HOOC-RCH-NH3+
+ H2O = -OOC-RCH-NH3+
+ H3O+ pKa1=
2,3 AH+ + H2O = A+ H3O+ ; Ka1 = [A] h / [AH+] = 10-2,3 = 0,005. A + H2O = A- + H3O+ ; Ka2 = [A-]h / [A]= 10-9,9 = 1,25 10-10 conservation A : [AH+]+[A]+[A-]=0,1 ; or A majoritaire dans l'eau : [A] voisin 0,1 mol/L solution électriquement neutre : h+ [AH+] = [OH-]+[A-] hypothèse : h et [OH-] négligeable devant [AH+] et [A-] alors [AH+] =[A-] Ka1 * Ka2 = h²[A-] / [AH+] = 6,25 10-13 h²= 6,25 10-13 ; pH= 6,1. si on calcule [AH+] et [A-] on trouve : [AH+] = [A] h/Ka1 = 0,1 * 10-6,1 / 0,005 = 1,6 10-5 alors que h= 7,8 10-7 [A-] =Ka2[A]/h= 1,25 10-10*0,1/ 10-6,1 = 1,6 10-5 ; hypothèse confirmée
|
|
|
|