|
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts. |
|||||||||||
| .
. |
|||||||||||
|
|||||||||||
|
|
I. Traitement d'une eau naturelle : 6 pts Une eau naturelle de pH= 7,3 contient des ions manganèse Mn2+, à une concentration molaire c=2,0 10-6 mol/L, donc supérieure à la norme de 9,0 10-7 mol/L. Pour éliminer les ions manganèse, on envisage de les oxyder en dioxyde de manganèse MnO2, insoluble dans l'eau, au moyen d'ion permanganate MnO4-. Le permanganate est lui aussi transformé en MnO2. Le dioxyde de manganèse est ensuite séparé par filtration. Les potentiels standart des couples envisagés sont les suivants : MnO4-/ MnO2 : E°1=1,68 V ; MnO2 /Mn2+ : E°2= 1,25 V
II. pH de l'eau d'une piscine : 6 pts Après traitement, l'eau précédente sert à remplir l'eau d'une piscine. Par contact avec l'atmosphère, cette eau dissout du dioxyde de carbone, ce qui a pour effet d'abaisser son pH.
III. action des ions permanganate sur les composés organiques : 3 pts On envisage les deux réactions suivantes : - action de l'ion permanganate dilué et froid sur le but-1-ène. - action de l'ion permanganate concentré et chaud sur le 2-méthylbut-2-ène.
corrigé MnO4- + 4H+ +3e- = MnO2+ 2 H2O MnO2 + 4H+ +2e-= Mn2++ 2 H2O E1= E°1+ 0,06 / 3 log ([MnO4-]/ [H+]4) avec [MnO4-] = 10-3 / 1000 = 10-6 mol/L ; [H+] = 10-pH= 10-7,3 =5 10-8 mol/L E1=1,68 + 0,02 log(10-6 / (5 10-8)4)= 2,15 V. E2= E°2+ 0,06 / 2 log( [H+]4 / [Mn2+] ) avec [Mn2+] = 2 10-6 mol/L E2=1,25 + 0,03 log( (5 10-8)4/2 10-6 ) = 0,54 V. à l'équilibre E1=E2 ; E°1+ 0,06 / 3 log ([MnO4-]/ [H+]4) = E°2+ 0,06 / 2 log( [H+]4 / [Mn2+] ) E°1+ 0,01 log ([MnO4-]2/ [H+]8) = E°2+ 0,01 log( [H+]12 / [Mn2+]3 ) (E°1-E°2/0,01 = log ( [H+]4 /([Mn2+]3 (MnO4-]2) = log K log K= 100(1,68-1,25) = 43 ; K= 10 43. K est très grand donc : MnO4- oxydant le plus fort, réduit Mn2+, réducteur le plus fort. 2 fois {MnO4- + 4H+ +3e- = MnO2+ 2 H2O } 3 fois { Mn2++ 2 H2O = MnO2 + 4H+ +2e-} 2 MnO4- +3 Mn2++2 H2O = 5 MnO2+ 4H+ . constante d'équilibre K En fin de réaction : 10-3 mol MnO4- a réagi avec 1,5 10-3 mol d'ion Mn2+ d'après les coefficients de l'équation ci-dessus. Qté initiale d'ion Mn2+ dans 1000 L : 2 10-3 mol. il reste : 2 10-3-1,5 10-3 = 5 10-4 mol d'ion Mn2+ dans 1000 L soit [Mn2+]= 5 10-7 mol/L l'eau est alors conforme à la norme. CO2 + 2H2O= HCO3- + H3O+. Ka1= [HCO3-][ H3O+]/[CO2] dis = 10-6,4 = 4 10-7. HCO3- + H2O= CO32-+ H3O+. Ka2= [ CO32-][ H3O+]/[HCO3- ] = 10-10,3 = 5 10-11. en prenant en compte uniquement la première réaction ( Ka1>>Ka2), écrire l'électroneutralité de la solution : [HCO3-] + [HO-]= [ H3O+] ; si [HO-] négligeable devant [ H3O+] : K1= [ H3O+]2/[CO2] dis ; [ H3O+]2 =K1[CO2] dis = 4 10-7 *9,9 10-6 =3,96 10-13 ; [ H3O+] = 6,3 10-7 et pH= 6,2. à 25°C, [HO-] = 10-14 / 6,3 10-7 =1,6 10-8 mol/L ( 40 fois plus faible que [ H3O+], approximation judtifiée). Relever le pH : CO32- + H3O+ =HCO3- + H2O (1) et HCO3- +H3O+ = [CO2] dis + 2H2O (2) (1) + (2) donne : CO32- +2 H3O+ = [CO2] dis + 2 H2O (3); Kr= [CO2] dis / ([CO32-][H3O+]2). Or Ka1 = [HCO3-] [H3O+] / [CO2] dis et Ka2= [CO32- ] [H3O+] / [HCO3-] Kr=1/(Ka1Ka2)= 1/(4 10-7* 5 10-11)= 5 1016. Kr est très grand, la réaction (3) est totale. [H3O+]2 = [CO2] dis /(Kr [CO32-]/ )= 9,9 10-6 / (5 1016 [CO32-]) = 2 10-22 / [CO32-] en ajoutant des ions carbonates, on fait croître [CO32-]
et en conséquence [H3O+]
diminue : or pH= - log [H3O+]
donc le pH augmente.
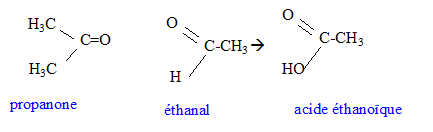
le but-1-ène conduit à un diol : le 2-méthylbut-2-ène conduit à une cétone et à un acide carboxylique :
|
||||||||||
|
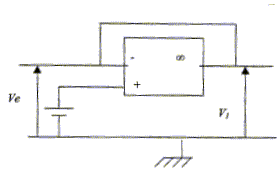
On utilise l'eau de javel. La concentration en chlore ne doit pas descendre en dessous de 0,3 g de chlore par m3 d'eau. Cette concentration doit être maintenue entre 0,3 et 0,7 g/m3. L'eau du bassin est aspirée en surface et en profondeur. Elle est alors filtrée et traitée, puis réinjectée dans le bassin. Le débit nécessaire est assuré par une motopompe. Le schéma fonctionnel de la régulation est le suivant : 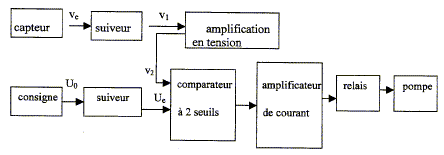 Les AO sont supposés idéaux et leur alimentation se fait sous une tension égale à + 12 V. Seuls seront étudiés le capteur, le suiveur et l'amplificateur.
corrigé 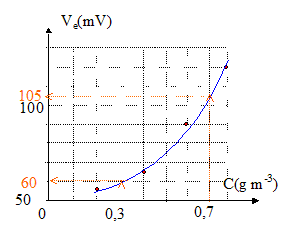
dans un montage suiveur, la tension d'entrée est égale à la tension de sortie : Ve=V1. amplification : tension de sortie / tension d'entrée = 3/0,06 = 50.
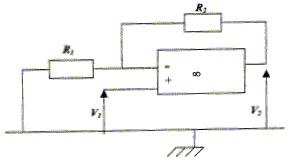
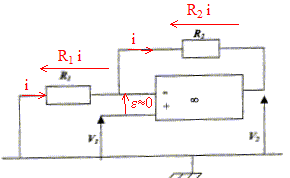
V2 + R1i + R2i=0 soit V2 =( R1+ R2) i (1); V1 = R1i soit i = V1 / R1 ; repport dans (1) : V2 =V1( R1+ R2) / R1 =V1( 1+ R2/ R1) V2 / V1 = 50 ; R1 = 10 kW ; R2=R1( V2 / V1-1) = 10*49 = 490 kW. |
|||||||||||
|
|
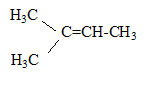 2-méthylbut-2-ène
2-méthylbut-2-ène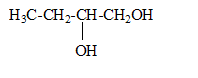 butan-1,2-diol
butan-1,2-diol