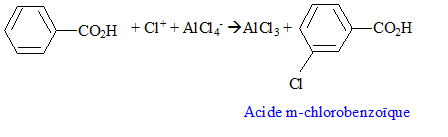|
d'après bts biotechnologie 2005 En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts. |
|||||||||||||||||||||||||||||||||||||||||||||||||
| .
. |
|||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||
|
|
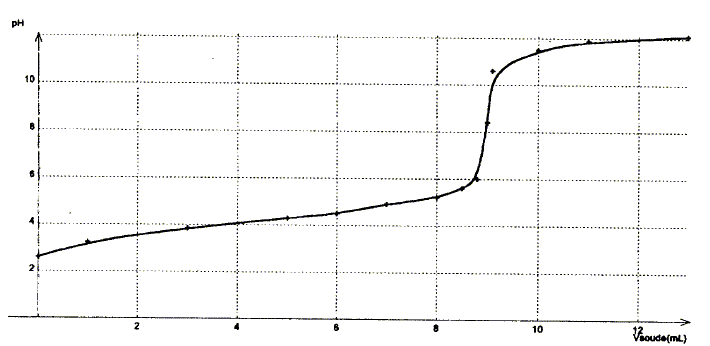
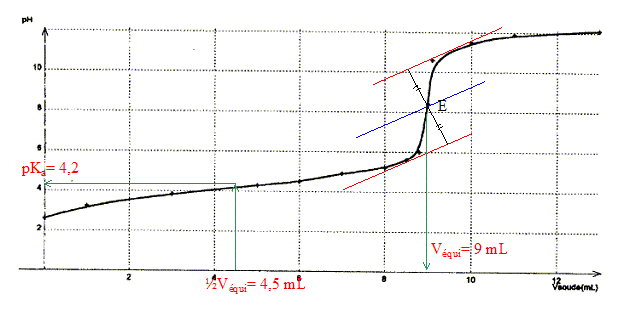
Données : à 25°C pKe= 10-14 ; pKd(Ag(NH3)2+)=7,2. Détermination de la valeur du pKa du couple NH4+ / NH3 par plusieurs méthodes :
corrigé dissociation de NH4Cl dans l'eau : NH4Cl = NH4+(aq) + Cl-(aq) équation du couple acide base NH4+ / NH3 : NH4++ H2O = NH3 + H3O+ avec Ka = [NH3][H3O+]/[NH4+] [NH3]= [H3O+] = 10-pH = 10-4,9 = 1,26 10-5 mol/L conservation de l'élément azote : [NH4+] + [NH3] = c= 0,25mol/L [NH3] négligeable devant [NH4+] d'où [NH4+] voisin 0,25mol/L; NH4+ réagit partiellement avec l'eau. par suite Ka=
( 1,26 10-5)2/0,25 = 6,3
10-10 soit pKa = 9,2.
Une solution tampon ne change pas de pH par dilution ; de plus elle modère les variations de pH dus à l'ajout modéré d'un acide ou d'une base. pH = pKa + log ([NH4+]/[NH3]) Or [NH4+]=
[NH3] d'où pH = pKa =9,2.
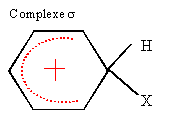
Les atomes d'argent et d'azote sont alignés. Ag(NH3)2+ =Ag+ + 2NH3 avec KD= [NH3]2[Ag+]/[Ag(NH3)2+] constante de
formation du complexe Kf= 1/KD.
multiplier numérateur et dénominateur par [NH3]2 K= [NH4+]2[Ag+][NH3]2 / ([Ag(NH3)2+][H3O+]2[NH3]2) faire apparaître KD et Ka : K= [Ag+][NH3]2 / [Ag(NH3)2+]* [NH4+]2 /([H3O+]2[NH3]2)= KD/ K2a. Calcul de K : 99% du complexe disparaît soit [Ag+] / ([Ag(NH3)2+] = 99 ; [H3O+] = 10-pH= 10-6 mol/L ; si initialement [Ag(NH3)2+] = 0,02 mol/L alors après dissolution du complexe [NH4+] = 0,04 mol/L K= 0,042*99/10-12 = 1,58 1011. Or K2a = KD /K= 10-7,2 /1,58 1011= 4 10-19 ; Ka = 6,3 10-10 ; pKa = 9,2.
|
||||||||||||||||||||||||||||||||||||||||||||||||
|
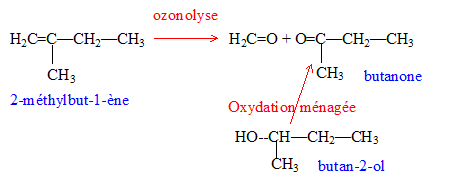
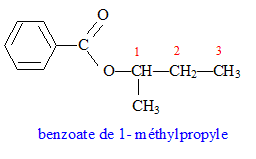
On réalise l'hydrolyse d'un ester A. On obtient deux produits B et C.
corrigé L'hydrolyse d'un ester donne un acide et un alcool ; un alcool secondaire donne par oxydation ménagée une cétone. L'ozonolyse permet d'identifier la butanone CH3-CO-CH2-CH3. L'alcool secondaire B est donc le butan-2-ol. CH3-CHOH-CH2-CH3 ou C4H10O
2 fois {MnO4- + 8H++5e-=Mn2++4H2O} réduction 5 fois { C4H10O = C4H8O + 2H++2e- } oxydation 2MnO4- + 5C4H10O +6H+= 2Mn2++5 C4H8O +8H2O
On identifie C : l'acide benzoïque. On fait réagir du dichlore en présence de chlorure d'aluminium sur C : chloration du cycle benzénique, on remplace un hydrogène du cycle par un chlore.
le groupe -CO2H est un désactivant puissant ; il oriente la substitution en méta. type d'intermédiaire réactionnel : type de réaction : substitution électrophile sur le noyau benzénique.
|
|||||||||||||||||||||||||||||||||||||||||||||||||
|
Les deux séries d'expériences ci-dessous sont coramment présentées : 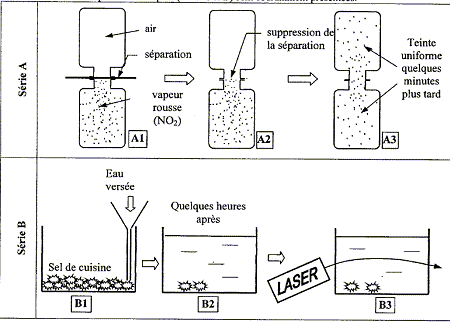
corrigé série A : le gaz diffuse du compartiment ayant la plus forte pression vers celui où la pression est la plus faible, jusqu’à équilibre des pressions. série B : la répartition du sel tend à devenir homogène. Il y a donc transport du sel depuis le fond du récipient dans tout le liquide ; de la région la plus concentrée vers les régions les moins concentrées, de afin de réaliser l'égalité des concentrations. Cette évolution est irréversible. L'expérience B3 met en évidence un gradient de concentration dans la solution : la lumière du laser ne se propage pas en ligne droite ; la solution est hétérogène.
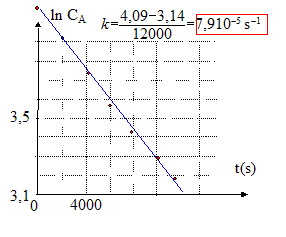
CA0 = 60 kg m-3 équation de la droite : ln CA= ln CA0 - kt soit ln( CA/CA0 )= -kt ; CA/CA0 = e(-kt) ; CA=CA0e(-kt) ; k= DS / (VA e) s'écrit : D= kVA e/S avec VA= 10-3 m3 ; e= 10-4 m ; S= 10-2 m². D= 8 10-5 *10-3 *10-4 / 10-2 =8 10-10 m2s-1. durée nécessaire pour que la concentration de l'urée diminue de moitié: ln( CA/CA0 )=ln 0,5 = -0,693 = -kt; t = 0,693 /8 10-5 = 8664 s.
|
|||||||||||||||||||||||||||||||||||||||||||||||||
|
|