|
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptés à vos centres d’intérêts. |
||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||
|
|
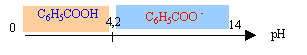
Propriétés de l'acide benzoïque Les conservateurs sont des substances qui prolongent la durée de conservation des denrées alimentaires en les protégeant des altérations des micro-organismes. L'acide benzoïque C6H5-COOH ( code E210) et le benzoate de sodium C6H5-COONa ( code E211) sont utilisés dans l'industrie comme conservateurs alimentaires pour leurs propriétés fongicides et antibactériennes. Acide benzoïque : solide blanc, masse molaire M= 122 g/mol, solubilité dans l'eau ( masse maximale que l'on peut dissoudre dans 1 L d'eau) : 2,4 g/L à 25°C. Couple acide base C6H5-COOH / C6H5-COO- pKa1 = 4,2 Réaction de l'acide benzoïque avec l'eau : On introduit une masse m0 d'acide benzoïque dans un volume V0= 100 mL d'eau distillée. Après dissolution totale, on obtient une solution aqueuse d'acide benzoïque notée S0 de concentration C0 = 1,0 10-2 mol/L. Le pH-mètre indique 3,1 pour le pH de la solution S0.
Réaction de l'acide benzoïque avec la soude. On ajoute à la solution S0 quelques gouttes de soude ( hydroxyde de sodium). Le pH-mètre indique alors 6,2.
Synthèse du benzoate de méthyle. On le prépare à partir de la réaction entre l'acide benzoïque et le méthanol de formule CH3OH. On mélange une masse m1 = 12,2 g d'acide benzoïque avec un volume V2 = 30 mL de méthanol, quelques gouttes d'une solution concentrée d'acide sulfurique et quelques grains de pierre ponce. On chauffe à reflux pendant 60 minutes. Après refroidissement, on verse le contenu du ballon dans une ampoule à décanter contenant de l'eau glacée. On obtient deux phases bien distinctes. Après traitement de la phase contenant l'ester , on isole une masse égale à 9,52 g de benzoate de méthyle.
masse m0 à peser pour préparer S0 : quantité de matière (mol) = concentration (mol/L) * volume de la solution (L) = C0V0 = 0,01*0,1 = 1,0 10-3 mol masse (g) = quantité de matière (mol) * masse molaire (g/mol) = 10-3*122 = 0,12 g. 0,12 g dans 0,1 L soit 1,2 g/L, valeur inférieure à la solubilité dans l'eau à 25°C : la solution n'est pas saturée. Equation de la réaction de l'acide benzoïque avec l'eau : C6H5COOH + H2O = C6H5COO- + H3O+. à pH inférieur à pKa la forme acide AH prédomine; à pH supérieur à pKa la forme base conjuguée A- prédomine; à pH=pKa les forme acide et base conjuguée sont en quantités égales.
Dans S0 ( pH=3,1, inférieur au pKa) la forme acide C6H5COOH du couple acide base prédomine. Tableau
d'avancement :
en grand excès taux d'avancement final t = xéq / xmax avec xéq = [H3O+]V0 ; t =[H3O+] / C0 = 10-3,1 / 10-2 = 10-1,1 = 7,9 10-2. La réaction de l'acide benzoïque avec l'eau est limitée ; la forme acide prédomine ( en accord avec la question précédente) Expreesion du quotient de réaction à l'état d'équilibre : Qr éq = Ka = [C6H5COO-]éq[ H3O+ ] éq / [C6H5COOH]éq La solution est électriquement neutre ( HO- minoritaire à pH = 3,1) : [C6H5COO-]éq=[ H3O+ ] éq conservation de l'élément carbone : [C6H5COOH]éq +[C6H5COO-]éq= C0. [C6H5COOH]éq = C0-[C6H5COO-]éq. Qr éq =[ H3O+ ]² éq / (C0-[ H3O+ ] éq ) = 10-6,2 / (0,01-10-3,1) =6,8 10-5. pKa du couple ( acide benzoïque/ ion benzoate) : Qr éq = Ka ; pKa
= -log Ka = - log6,8 10-5
= 4,2.
pH=6,2 , valeur bien supérieure à pKa ( 4,2) : l'ion benzoate C6H5COO- prédomine. Equation de la réaction entre l'acide benzoïque et la soude : C6H5COOH + HO- =C6H5COO- + H2O constante d'équilibre K= [C6H5COO-]/([C6H5COOH][HO-]) (1) or Ka = [C6H5COO-][ H3O+ ] / [C6H5COOH] soit[C6H5COO-] / [C6H5COOH] = Ka / [ H3O+ ] repport
dans (1) : K =Ka / ([ H3O+
] [HO-]) =Ka
/Ke = 10-4,2
/ 10-14 = 109,8 =6,3 109.
n1 =m1/M( acide benzoïque) = 12,2 / 122 = 0,10 mol masse méthanol (g = volume (mL) * masse volumique (g/mL) = 30 *0,8 = 24 g ; pui diviser par la masse molaire du méthanol : n2 = 24/32 = 0,75 mol. facteurs cinétiques : concentration d'un réactif : le méthanol est en large excès ; température : chauffage à reflux à température modérée ; catalyseur : rôle joué par l'acide sulfurique. utilité du chauffage à reflux : accélère la réaction en permettant de travailler à température modérée ; évite les pertes de matière : les vapeurs se condensent dans le réfrigérant et retombent dans le ballon. Equation de la réaction de synthèse du benzoate de méthyle : C6H5COOH + CH3OH =C6H5COO-CH3 + H2O. à partir de 0,1 mol d'acide on peut consommer au plus 0,1 mol de méthanol ; or on dispose de 0,75 mol de méthanol : ce dernier est en excès et l'acide benzoïque constitue le réactif limitant. En conséquence on obtiendra au plus 0,1 mol de benzoate de méthyle. rendement : Qté réellement obtenue / Qté théorique Qté réelle (mol) = masse (g) / masse molaire ester (g/mol ) = 9,52 / 136=7,0 10-2 mol. rendement : 0,07/0,1 = 0,70 (70%) |
|||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||
|
|