|
Le piège photo, conservateur et parfum , production d'énergie nucléaire d'après bac S USA 2006 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptés à vos centres d’intérêts. |
|||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||
|
|
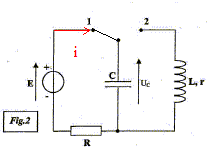
Cet exercice étudie le principe de fonctionnement d'un piège photo réalisé par un ornithologue afin d'identifier le prédateur d'une espèce d'oiseau en voie de disparition. Un œuf de caille posé sur un commutateur à bascule sert d'appât dans un vieux nid. Lorsque le prédateur prélève l'œuf, le commutateur bascule de la position 0 à la position 2. Le condensateur initialement chargé se décharge dans un électroaimant que l'on peut modéliser par une bobine d'inductance L et de résistance interne r. L'électroaimant, placé sur un appareil photo déclenche la prise de vue. Le circuit de charge est constitué d'un condensateur de capacité C, d'un conducteur ohmique de résistance R et d'un générateur idéal de tension de fem E= 8 V. 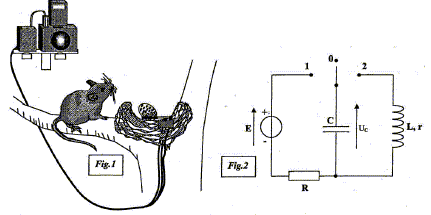 I- Armement du dispositif. Le dispositif s'arme en plaçant le commutateur en position 1 pendant la durée nécessaire à la charge du condensateur. Cette opération réalisé, l'œuf est déposé sur le bras du commutateur à bascule qui est ainsi maintenu en position O.
Déclenchement du piège Lorsque l'œuf est prélevé, le commutateur bascule de la position 0 à la position 2. Un enregistrement de la tension uc(t) aux bornes du condensateur est réalisé lors de l'étude de ce dispositif.
Détermination de l'inductance L de la bobine constituant l'électroaimant. On place cette bobine en série avec un condensateur de capacité C'= 10 nF initialement chargé sous une tension de 6V et une résistance R' tel que R'+r= 50 ohms. Le circuit ainsi constitué est représenté ci-dessous : 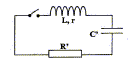 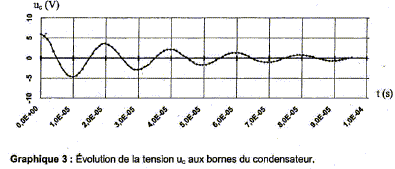 L'évolution de la tension aux bornes du condensateur a été enregistrée à la fermeture de l'interrupteur.
corrigé sens réel du courant i lors de la charge :
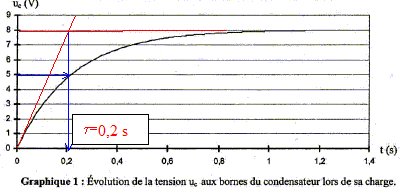
équation différentielle vérifiée par uc(t) lors de la charge : uc+Ri =E (1) (loi d'additivité des tensions) de plus i = dq/dt et q=Cuc soit i = Cduc/dt ; repport dans (1) d'où : uc+RCduc/dt = E On pose t = RC ; par suite : uc+t duc/dt = E analyse dimensionnelle : R résistance soit tension / intensité ; C capacité soit charge / tension d'où on déduit : RC charge / intensité or une charge est une intensité fois un temps ; par suite RC a la dimension d'un temps. valeur de uc(t) en régime permanent : en régime permanent uc(t) est constant : donc duc/dt = 0 ; uc+t duc/dt = E s'écrit : Uc=E. solution de l'équation différentielle : uc(t) = A(1-exp(-t/t)) ; dériver par raport au temps ; duc/dt = A/t exp(-t/t) repport dans l'équation différentielle : A(1-exp(-t/t)) + A exp(-t/t) = E A- A exp(-t/t)+ A exp(-t/t) = E uc(t) = A(1-exp(-t/t)) est solution de l'équation différentielle si A= E. tension aux bornes du condensateur à t=5t : uc(5t) = E(1-exp(-5t/t)) =E(1-exp(-5)) = 0,993 E à 0,7 % près on peut considérer que la charge du condensateur est terminée. valeur de t :
abscisse de l'intersection de la tangente à t=0 avec l'asymptote horizontale ou bien abscisse correspondant à uc= 0,63 E= 0,63*8 = 5 V. La charge du condensateur est pratiquement terminée à t = 5 t soit 1 s. Durée caractéristique : à t½ uc = ½E = 4 V
L'énergie initialement stockée dans le condensateur doit être la plus grande possible : E =½CE² en fin de charge Cette énergie sera d'autant plus grande que E sera plus grand et que la capacité C sera plus grande. 
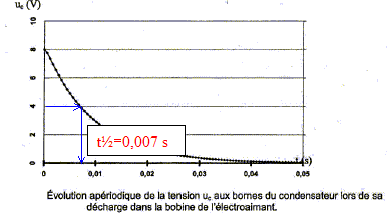
Nom du régime correspondant au graphe ci-dessus : régime pseudo-périodique. Inductance de la bobine : pseudo-période T= 2,0 10-5 s (lecture graphe) de plus T= 2p(LC)½ ; T² = 4p² LC soit L= T²/(4p² C) avec C= 10-8F. L= 4 10-10/(4*3,14² 10-8)= 1,0 10-3 H.
|
||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||
|
Propriétés de l'acide benzoïque Les conservateurs sont des substances qui prolongent la durée de conservation des denrées alimentaires en les protégeant des altérations des micro-organismes. L'acide benzoïque C6H5-COOH ( code E210) et le benzoate de sodium C6H5-COONa ( code E211) sont utilisés dans l'industrie comme conservateurs alimentaires pour leurs propriétés fongicides et antibactériennes. Acide benzoïque : solide blanc, masse molaire M= 122 g/mol, solubilité dans l'eau ( masse maximale que l'on peut dissoudre dans 1 L d'eau) : 2,4 g/L à 25°C. Couple acide base C6H5-COOH / C6H5-COO- pKa1 = 4,2 Réaction de l'acide benzoïque avec l'eau : On introduit une masse m0 d'acide benzoïque dans un volume V0= 100 mL d'eau distillée. Après dissolution totale, on obtient une solution aqueuse d'acide benzoïque notée S0 de concentration C0 = 1,0 10-2 mol/L. Le pH-mètre indique 3,1 pour le pH de la solution S0.
Réaction de l'acide benzoïque avec la soude. On ajoute à la solution S0 quelques gouttes de soude ( hydroxyde de sodium). Le pH-mètre indique alors 6,2.
Synthèse du benzoate de méthyle. On le prépare à partir de la réaction entre l'acide benzoïque et le méthanol de formule CH3OH. On mélange une masse m1 = 12,2 g d'acide benzoïque avec un volume V2 = 30 mL de méthanol, quelques gouttes d'une solution concentrée d'acide sulfurique et quelques grains de pierre ponce. On chauffe à reflux pendant 60 minutes. Après refroidissement, on verse le contenu du ballon dans une ampoule à décanter contenant de l'eau glacée. On obtient deux phases bien distinctes. Après traitement de la phase contenant l'ester , on isole une masse égale à 9,52 g de benzoate de méthyle.
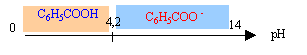
corrigé masse m0 à peser pour préparer S0 : quantité de matière (mol) = concentration (mol/L) * volume de la solution (L) = C0V0 = 0,01*0,1 = 1,0 10-3 mol masse (g) = quantité de matière (mol) * masse molaire (g/mol) = 10-3*122 = 0,12 g. 0,12 g dans 0,1 L soit 1,2 g/L, valeur inférieure à la solubilité dans l'eau à 25°C : la solution n'est pas saturée. Equation de la réaction de l'acide benzoïque avec l'eau : C6H5COOH + H2O = C6H5COO- + H3O+. à pH inférieur à pKa la forme acide AH prédomine; à pH supérieur à pKa la forme base conjuguée A- prédomine; à pH=pKa les forme acide et base conjuguée sont en quantités égales.
Dans S0 ( pH=3,1, inférieur au pKa) la forme acide C6H5COOH du couple acide base prédomine. Tableau
d'avancement :
en grand excès taux d'avancement final t = xéq / xmax avec xéq = [H3O+]V0 ; t =[H3O+] / C0 = 10-3,1 / 10-2 = 10-1,1 = 7,9 10-2. La réaction de l'acide benzoïque avec l'eau est limitée ; la forme acide prédomine ( en accord avec la question précédente) Expreesion du quotient de réaction à l'état d'équilibre : Qr éq = Ka = [C6H5COO-]éq[ H3O+ ] éq / [C6H5COOH]éq La solution est électriquement neutre ( HO- minoritaire à pH = 3,1) : [C6H5COO-]éq=[ H3O+ ] éq conservation de l'élément carbone : [C6H5COOH]éq +[C6H5COO-]éq= C0. [C6H5COOH]éq = C0-[C6H5COO-]éq. Qr éq =[ H3O+ ]² éq / (C0-[ H3O+ ] éq ) = 10-6,2 / (0,01-10-3,1) =6,8 10-5. pKa du couple ( acide benzoïque/ ion benzoate) : Qr éq = Ka ; pKa
= -log Ka = - log6,8 10-5
= 4,2.
pH=6,2 , valeur bien supérieure à pKa ( 4,2) : l'ion benzoate C6H5COO- prédomine. Equation de la réaction entre l'acide benzoïque et la soude : C6H5COOH + HO- =C6H5COO- + H2O constante d'équilibre K= [C6H5COO-]/([C6H5COOH][HO-]) (1) or Ka = [C6H5COO-][ H3O+ ] / [C6H5COOH] soit[C6H5COO-] / [C6H5COOH] = Ka / [ H3O+ ] repport
dans (1) : K =Ka / ([ H3O+
] [HO-]) =Ka
/Ke = 10-4,2
/ 10-14 = 109,8 =6,3 109.
n1 =m1/M( acide benzoïque) = 12,2 / 122 = 0,10 mol masse méthanol (g = volume (mL) * masse volumique (g/mL) = 30 *0,8 = 24 g ; pui diviser par la masse molaire du méthanol : n2 = 24/32 = 0,75 mol. facteurs cinétiques : concentration d'un réactif : le méthanol est en large excès ; température : chauffage à reflux à température modérée ; catalyseur : rôle joué par l'acide sulfurique. utilité du chauffage à reflux : accélère la réaction en permettant de travailler à température modérée ; évite les pertes de matière : les vapeurs se condensent dans le réfrigérant et retombent dans le ballon. Equation de la réaction de synthèse du benzoate de méthyle : C6H5COOH + CH3OH =C6H5COO-CH3 + H2O. à partir de 0,1 mol d'acide on peut consommer au plus 0,1 mol de méthanol ; or on dispose de 0,75 mol de méthanol : ce dernier est en excès et l'acide benzoïque constitue le réactif limitant. En conséquence on obtiendra au plus 0,1 mol de benzoate de méthyle. rendement : Qté réellement obtenue / Qté théorique Qté réelle (mol) = masse (g) / masse molaire ester (g/mol ) = 9,52 / 136=7,0 10-2 mol. rendement : 0,07/0,1 = 0,70 (70%) |
|||||||||||||||||||||||||||||||||||||||||||
|
Fission nucléaire : Une centrale nucléaire est une usine de production d'électricité. Actuellement ces centrales utilisent la chaleur produite par des réactions de fission de l'uranium 235 qui constitue le " combustible nucléaire ". Cette chaleur transforme de l'eau en vapeur. La pression de la vapeur permet de faire tourner à grande vitesse une turbine qui entraîne un alternateur produisant de l'électricité. Certains produits de fission sont des noyaux radioactifs de forte activité et dont la demi-vie peut être très longue.
Fusion nucléaire : Le projet ITER s'installera prochainement sur le site de Cadarache en France. L'objectif de ce projet est de démontrer la possibilité scientifique et technologique de la production d'énergie par fusion des atomes. La fusion est la source d'énergie du soleil et des autres étoiles. Pour obtenir une réaction de fusion il faut rapprocher suffisamment deux noyaux qui se repoussent, puisqu'ils sont tous deux chargés positivement. Une certaine énergie est donc indispensable pour franchir cette barrière et d'arriver dans la zone très proche du noyau, où se manifestent les forces nucléaires capables de l'emporter sur la répulsion électrostatique. La réaction de fusion la plus accessible est la réaction impliquant le deutérium et le tritium. La demi-vie du tritium consommé au cours de cette réaction n'est que de 15 ans. De plus il y a peu de déchets radioactifs générés par la fusion et l'essentiel est retenu dans les structures de l'installation ; 90% d'entre eux sont de faible ou moyenne activité.
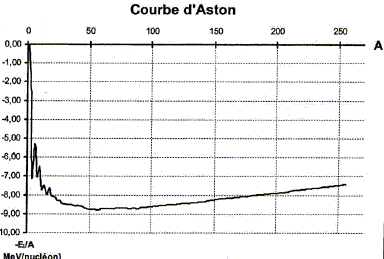
corrigé demi-vie : durée au bout de laquelle la moitié des noyaux initiaux se sont désintégrés. activité : nombre moyen de désintégrations par seconde ( unité : bequerel (Bq)) valeurs de A et Z : 23592U + 01n--->94ZSr+ A54Xe + 3 01n conservation de la charge : 92 = Z+54 d'où Z= 92-54 = 38 conservation du nombre de nucléons : 235+1=94+A+3 soit A = 139. énergie libérée par cette réaction de fission : Dm = 2 m( 01n) + m(A54Xe)+m(94ZSr)- m(23592U) = 2*1,00866+138,8892+93,8945-234,9942 =-0,19318 u soit 0,19318 * 931,5 = 180 MeV énergie libérée par nucléon de matière : 180/236 = 0,762 MeV/nucléon. isotopes : deux noyaux qui ne diffèrent que par leur nombre de neutrons ; ils ont le même nombre de charge Z le noyau de deutérium D contient 1 proton et 1 neutron : 21H ; le noyau de tritium T contient 1 proton et 2 neutrons : 31H. D et T sont des isotopes de l'élément chimique hydrogène. réaction de fusion : réaction au cours de laquelle deux noyaux légers s'unissent pour former un noyau plus lourd. La réaction se fait avec perte de masse et dégagement d'énergie. courbe d'Aston : Le noyau de fer est le plus stable ; les gros noyaux ( uranium 235) situés sur la partie droite sont instables et conduisent par des réactions de fission à d'autres noyaux plus stables ; les petits noyaux instables ( deutérium, tritium), situés sur la partie gauche, conduisent par des réactions de fusion à des noyaux plus gros et plus stables. Equation de la réaction nucléaire entre un noyau de Deutérium et un noyaude Tritium au cours de laquelle se forme un noyau d'hélium 42He : 31H +21H --> 42He + 10n énergie DE qui peut être libérée par cette réaction : |Dm |= | m(42He)+m(10n)- m(31H) - m(21H)|=|4,0015+1,00866-2,01355-3,0155|= 1,89 10-2 u puis 1,89 10-2*931,5= 17,6 MeV. énergie libérée par nucléon : 17,6 / 5 = 3,52 MeV/nucléon. avantages de la fusion par rapport à la fission : l'énergie libérée par nucléon est plus importante ; Deutérium abondant et bon marché ; Tritium assez facile à produire ; déchets radioactifs moins importants et absence de nucléides conduisant à la prolifération des armes nucléaires.
|
|||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||
|
|