|
-
Propagation d'une onde :
On fixe un vibreur à l'extrémité d'une corde tendue. Une onde
sinusoïdale de fréquence f = 25 Hz se propage le long de la corde. Le
milieu n'est pas dispersif.
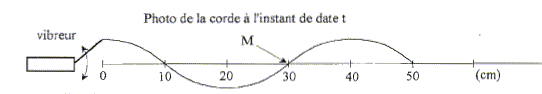
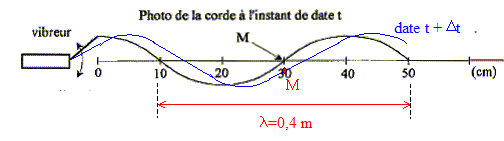
L'onde est transversale : sa direction de propagation est
perpendiculaire à la direction de la déformation du milieu.
La célérité de l'onde v est égale à la longueur d'onde l (m)
multipliée par la fréquence f (Hz).
l = 40 cm = 0,4 m ; f = 25 Hz d'où v = 25*0,4 = 10 m/s.
Le milieu n'est pas dispersif : la célérité de l'onde ne dépend
pas de la fréquence de la source.
Au moment de la prise de vue, le point M descend.
Dans un milieu non dispersif, une onde rectiligne sinusoïdale traverse
une fente dont la largeur "a", fixe, est de l'ordre de grandeur de la
longueur d'onde l.
L'écart angulaire vaut q= l/a : la diffraction est d'autant plus marquée que cet
écart est important ( "a" étant fixé, l doit être grand)
Or l = v/f ; si l est grand, la fréquence f est petite.
d'où : la diffraction est d'autant plus marquée si la fréquence est
petite ( la largeur de la fente étant fixée et le milieu étant non
dispersif).
-
Radioactivité :
Le graphe représente l'évolution temporelle de l'activité A d'un
échantillon de radon 222.
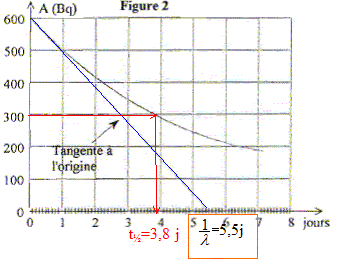
La demi-vie du radon 222 est : t1/2 = 3,8 jours
à l'instant de date t = 1,0 jour, l'activité est A=
500 Bq ;
Or A= lN ; N=A /l avec 1/l = 5,5 jours = 5,5*24*3600 secondes =4,75 105
s.
il reste N= 500* 4,75 105 =2,4 108 noyaux de
radon 222 dans l'échantillon.
-
Évolution des systèmes
électriques :
La résistance du circuit de la figure
ci-dessous est réglable.
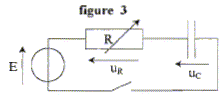
Le générateur délivre une tension constante E = 6,0 V. Le condensateur
a une capacité C = 1,0 µF.
Un système d'acquisition permet d'enregistrer l'évolution de la tension
aux bornes du condensateur en fonction du temps.
À l'instant de date t = 0 s, on ferme
l'interrupteur.
A l'instant de date t = 0 s, le condensateur n'a pas
eu le temps de se charger : la tension à ces bornes est nulle.
En régime permanent l'intensité du courant qui circule dans le circuit
est nulle.
i = dq/dt = Cduc/dt avec uc = E=constante ; en
conséquence duc/dt =0.
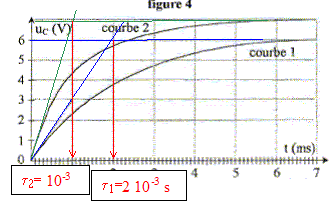
Pour obtenir la courbe 1, la valeur R est égale à : t1=2
ms = 2 10-3 s ( lecture graphe)
de plus t1 =RC avec C= 10-6 F d'où R= 2 10-3 /
10-6 = 2000 W.
courbe 2 : la valeur finale de uC vaut 7 V
; t2=1 ms = 1 10-3 s
de plus t2 =RC avec C= 10-6 F d'où R= 10-3 /
10-6 = 1000 W.
-
La résistance du circuit
ci-dessous est réglable. Le générateur délivre une tension constante E
= 6,0 V. La bobine a une résistance interne négligeable devant R et une
inductance L. Un système d'acquisition permet d'enregistrer l'évolution
au cours du temps de l'une des tensions indiquées sur le schéma.
A l'instant de date t = 0 s, on ferme
l'interrupteur.
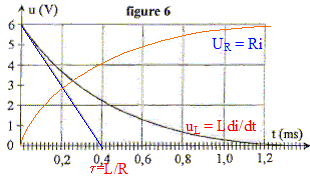
L'intensité du courant qui circule dans le circuit vérifie l'équation différentielle :
uR= Ri ; uL= Ldi/dt
additivité des tensions : uR+uL=E ; Ri + Ldi/dt =E.
Les courbes ci-dessous représentent uL et uR :
en régime permanent l'intensité est constante ; di/dt = 0 d'où E=RImax
soit Imax= E/R
-
Évolution des systèmes
chimiques :
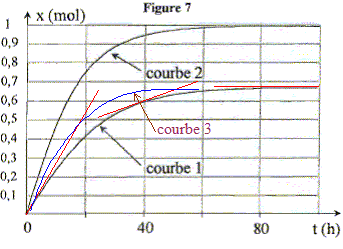
La courbe l ci-dessous représente l'évolution au cours du temps de
l'avancement de la réaction entre une mole d'acide éthanoïque et une
mole d'éthanol à 100°C sans catalyseur.
La réaction conduit à un équilibre
chimique.
A l'instant de date t = 0 h, la vitesse de la réaction est maximale : la tangente
est presque verticale ; le coefficient directeur de la tangente est
proportionnelle à la vitesse.
La vitesse de la réaction diminue au cours du temps,
du fait de la disparition des réactifs. Les tangentes sont de moins en
moins inclinées sur l'horizontale.
Une élévation de température du milieu réactionnel, facteur
cinétique, augmente la vitesse de réaction.
L'ajout d'un catalyseur dans le
milieu réactionnel permet d'atteindre plus rapidement l'équilibre sans
en changer la composition : la courbe 2 ne correspond pas à l'ajout
d'un catalyseur. La courbe 3 convient.
-
On étudie la réaction
d'oxydation de l'acide oxalique HOOC-COOH
(solution incolore) par l'ion permanganate
MnO4- (aq) en
milieu acide (solution de couleur
violette). Le suivi de la réaction est
réalisé par un enregistrement spectrophotométrique.
La transformation est totale. Parmi tous les réactifs et produits
présents dans le milieu réactionnel, seul
l'ion permanganate est coloré
et absorbe à la longueur d'onde choisie.
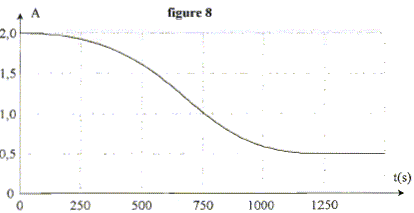
L'évolution de l'absorbance du milieu réactionnel en fonction du temps
est donnée sur le graphe ci-dessous.
L'ion permanganate n'est pas le réactif limitant : en effet
l'absorbance finale n'est pas nulle.
-
On réalise une pile avec les
couples Fe3+(aq)/Fe2+(aq) et Ag+(aq)/Ag(s).
Fe3+(aq) +Ag(s) = Fe2+(aq) + Ag+(aq)
La constante d'équilibre associée à la réaction vaut : K = 0,31.
Tous les ions en solution ont initialement la même concentration :
[Fe2+(aq)]ini =
[Fe3+(aq)]ini = [Ag+(aq)]ini
= 0,20 mol/L
Quand le courant circule dans le circuit extérieur,
la transformation qui s'effectue dans la pile est une transformation spontanée.
Qr,i = [Fe2+(aq)]ini [Ag+(aq)]ini
/ [Fe3+(aq)]ini = 0,2.
Qr,i < K : le sens spontané d'évolution de la réaction
est le sens direct.
En multipliant par 2 la
concentration initiale des ions Ag+(aq) sans changer les
autres concentrations, Qr,i devient égal à 0,4 :
Qr,i est alors supérieur à K : le sens spontané d'évolution
de la réaction est le sens inverse.
|








