|
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptés à vos centres d’intérêts. |
|||
|
|||
|
|
La purification des métaux par électrolyse est possible grâce à l'emploi d'une anode soluble. Le métal impur constitue l'anode : ce métal subit une oxydation et passe à l'état d'ion en solution. Les impuretés libérées tombent au fond de l'électrolyseur ou restent en suspension dans la solution. A la cathode les ions cuivre II en solution subissent une réduction, le métal très pur se dépose. La solution électrolytique contient des ions cuivre II Cu2+(aq), des ions sulfate et de l'acide sulfurique. Partie 1 :
Partie 2 : A l'aide du montage décrit dans la patie 1, on désire déposer par électrolyse une couche de cuivre sur une plaque d'acier. Lors de l'éectrolyse d'une durée Dt= 30,0 min, l'intensité du courant est constante et vaut I= 400 mA. M(Cu) = 63,5 g/mol ; NA=6,02 1023 mol-1 ; e= 1,60 10-19 C.
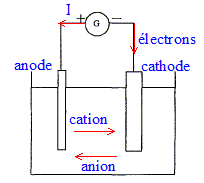
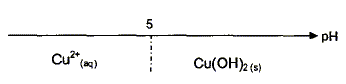
L'électrolyse est une réaction d'oxydoréduction forcée ; elle nécessite un apport d'énergie sous forme d'énergie électrique. équations des transformations aux électrodes : anode positive ( oxydation) : Cu (s) = Cu2+ + 2e-. cathode négative ( réduction) : Cu2+ + 2e- = Cu(s) bilan : Cu (s) + Cu2+ = Cu(s) + Cu2+ . anode soluble : le cuivre de l'électrode s'oxyde en ion Cu2+(aq) ; le métal de l'anode disparaît. Evolution de la concentration de la solution en ion Cu2+ : lorsqu'un ion cuivre II est réduit à la cathode, un ion cuivre II apparaît lors de l'oxydation à l'anode : en conséquence la concentration en ion cuivre II ne change pas. rôle de l'acide sulfurique : à pH supérieur à 5, on observe la précipitation de Cu(OH)2 ; le milieu doit avoir un pH inférieur à 5 : c'est le rôle de l'acide sulfurique ( d'autre part l'ion sulfate reste spectateur) la plaque d'acier doit se recouvrir de métal cuivre : elle joue le rôle de cathode ; sur cette plaque d'acier les ions cuivre II sont réduits en cuivre. Quantité d'électricité ( C) notée Q : intensité ( A) fois durée ( seconde) Q= I Dt De plus Q= ne NAe avec ne quantité de matière (mol) d'électron et e : charge élémentaire ou NAe = 1 faraday : en valeur absolue, charge d'une mole d'électrons. or à la cathode : Cu2+ + 2e- = Cu(s) d'où ne = 2 nCu. par suite : nCu = ½ne=½It / ( NAe ) masse de cuivre déposée sur l'acier : quantité de matière (mol) de cuivre * masse molaire (g/mol) mCu=nCu M(Cu) = ½neM(Cu) = ½It M(Cu) / ( NAe ) mCu=0,5*0,4*30*60*63,5 / (6,02 1023*1,60 10-19) = 2,37 10-1 g. explication de la variation de masse de la lame de cuivre |Dm|=2,41 10-1 g : Explication n°1 : dans la réalité, à la cathode d'autres espèces présentes ( H2O, ion oxonium) peuvent être réduites et concurence un peu la réduction des ions cuivre II. Explication n°2 : l'anode étant constituée de cuivre impur, une partie de ces impuretés se retouvent soit au fond de la cuve, soit dans la solution. En conséquence la masse de cuivre déposée est inférieure à la diminution de masse de l'anode.
|
||
|
|