|
Teneur en CO2 d'un vin d'après bac S Liban 2006 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptés à vos centres d’intérêts. |
|||||||||||||||||
|
|||||||||||||||||
|
|
Le vin est obtenu par fermentation du jus de raisin. Lors de la fermentation alcoolique, le glucose présent dans le raisin est dégradé en éthanol et en dioxyde de carbone CO2. Lorsque la vinification est terminée, on décèle généralement dans le vin la présence de CO2 à raison de 200 à 700 mg par litre. Pour déterminer la concentration en CO2 d'un vin, les laboratoires d'œnologie analysent, par spectrophotométrie, les échantillons que leur fournissent les viticulteurs. A l'aide d'un spectrophotomètre, l'absorbance de cet échantillon est mesurée pour une gamme de longueurs d'onde données (situées de part et d'autre du maximum d'absorption dû à la présence de CO2). Ces mesures sont ensuite reportées sur un graphe constituant le spectre d'absorption de l'échantillon pour la gamme de longueurs d'onde choisie. Dans tout cet exercice on considèrera que dans la gamme de longueurs d'onde choisies, seul le CO2 absorbe. Un élève cherche à déterminer la concentration en CO2 d'un échantillon de vin. Il dispose pour cela de quatre autres échantillons de vin de concentration en CO2 connues : Échantillon n°1 C1 = 4,5 mmol.L-1 Échantillon n°2 C2 = 10,4 mmol.L-1 Échantillon n°3 C3 = 24,3 mmol.L-1 Échantillon n°4 C4 = 29,5 mmol.L-1 Échantillon n°5 C5 à déterminer
Il réalise le spectre d'absorption de chacun de ces échantillons et obtient le graphe de l'absorbance en fonction de l'inverse de la longueur d'onde (le nombre d'onde 1/l) donné ci-dessous : 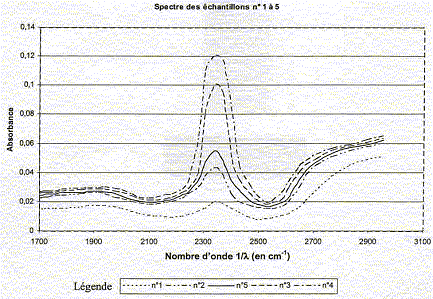
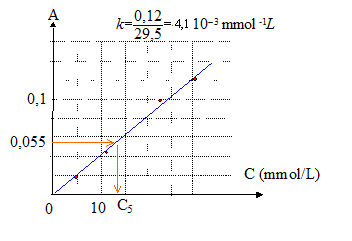
valeur de l'absorbance pour le maximum d'absorption de chaque échantillon :
allure de la courbe tracée : la courbe est une droite passant par l'origine : donc absorbance et concentration en CO2 sont proportionnelles La courbe obtenue est en accord avec la loi de Beer-Lambert valeur du coefficient e, en unités SI : k = 4,1 10-3 mmol-1 L soit k = 4,1 10-3 mol -1 m3. de plus k = eL soit e = k/L =4,1 10-3/3,5 10-3 =1,2 m² mol-1. concentration en CO2 de l'échantillon inconnu n°5 : A=kC soit C= A/k = 0,055/4,1 10-3 =13,4 mmol/L masse molaire CO2 : M= 44 g/mol puis 44*13,4 = 590 mg/L, valeur comprise entre 200 et 700 mg/L : le vin contenu dans cet échantillon entre dans la catégorie des vins cités dans le texte. |
||||||||||||||||
| |
|||||||||||||||||
|
|