|
Un acide rencontre une base. En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptés à vos centres d’intérêts. |
||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||
|
|
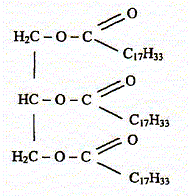
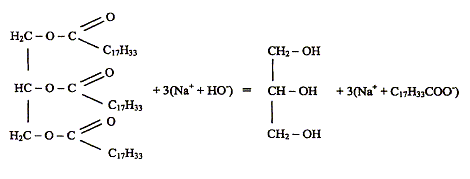
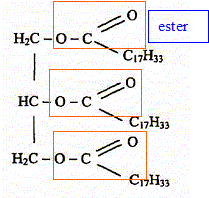
Une expérience instructive, très simple à réaliser, consiste à disposer du bicarbonate de soude au fond d'une flûte à champagne, puis à y ajouter délicatement de l'huile végétale claire et, au-dessus, du vinaigre (voir ci-dessous) : […] le vinaigre pénètre dans l'huile en formant des gouttelettes qui descendent au fond du verre. Puis, à peine touchent-elles le fond qu'elles remontent jusqu'à la surface, avant de redescendre à nouveau ...II faut attendre cinq bonnes minutes avant que cette danse ne s'arrête !... " "…Au bout du voyage, les gouttes entrent en contact avec le bicarbonate de soude. Cela provoque une réaction chimique qui conduit à une émission de dioxyde de carbone. Rapidement, le gaz ainsi créé s'agrège en bulles qui s'accrochent sur les gouttelettes de vinaigre. Le volume de ces bulles augmente jusqu'à ce qu'elles remontent, entraînant avec elles les gouttelettes. Une fois arrivées à la surface, les bulles éclatent. Résultat : débarrassées des bulles les petites gouttes de vinaigre redescendent dans l'huile. Et le manège recommence, jusqu'à disparition du vinaigre. D'après Alain Schuhl dans Science et Vie Junior N°165 juin 2003 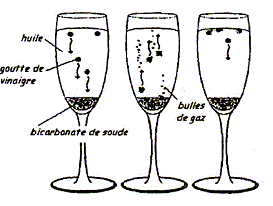 L'étude de la transformation chimique entre le bicarbonate de soude et le vinaigre fait l'objet cet exercice. Les parties 1, 2 et 3 sont Indépendantes. I Etude de l'huile : L'acide oléique a pour formule semi-développée H3C-(CH2)7-CH = CH-(CH2)7- OOH ; on le notera simplement C17H33COOH. On considère que l'huile alimentaire, utilisée dans l'expérience est composée uniquement de triester de l'acide oléique et du propan-1,2,3-triol de formule semi-développée HOCH2-CHOH-CH2OH.
II. Etude du vinaigre. Le vinaigre est une solution aqueuse d'acide acétique de formule CH3COOH. On mesure le pH d'une solution diluée. Le pH vaut 3,40 et la concentration de la solution diluée est 1,00.10-2 mol.L-1. Données :- Pour le couple acido-basique CH3COOH / CH3COO- , pKa = 4,75. Valeurs des conductivités molaires ioniques : l(H3O+) = 35,0 .10-3 S.m².mol-1 ; l(CH3COO-) = 4,09 .10-3 S.m².mol-1
III. Données et rappels : - Température absolue T : elle se mesure en kelvins (K) et vaut T = 273 + q, q étant la température exprimée en degrés Celsius (°C). - Loi des gaz parfaits : la pression p, le volume V et la température absolue T d'une quantité de matière n de gaz sont liés par la relation p.v = n.R.T. Dans le système international, la constante R vaut R = 8,31 J.K-1.mol-1. - Couples acido-basiques : On rappelle que le pKa du coupe acide acétique l' ion acétate vaut pKa = 4,75. Celui du couple CO2 ,H2O / HCO3- vaut pKa = 6,35 - On donne les masses molaires : M(NaHCO3) = 84 g.mol-1 et M(CH3COOH) = 60 g.mol-1 On considère la réaction chimique correspondant à la transformation qui a lieu lorsque la gouttelette de vinaigre touche le bicarbonate de soude solide se trouvant au fond du verre. Le " bicarbonate de soude " du commerce est en réalité de l'hydrogénocarbonate de sodium NaHCO3 (s). Le vinaigre est une solution aqueuse d'acide acétique CH3COOH (aq).
autre nom du propan-1,2,3-triol : glycérol
En milieu très basique (soude concentrée) et à chaud, l'huile subit une hydrolyse basique : saponification les produits obtenus : oléate de sodium ( savon) et glycérol équation modélisant la réaction chimique entre l'acide acétique et l'eau : CH3COOH + H2O=CH3COO- +H3O+. expression littérale de la constante d'équilibre associée à cette réaction : Ka = [CH3COO-][H3O+]/[CH3COOH] = 10-4,75 = 1,78 10-5. Etablir le tableau d'avancement de la réaction. Calculer le taux d'avancement de celle-ci : on raisonne sur 1L de solution
t <<1 , la transformation de l'acide acétique avec l'eau est très limitée Retrouver la valeur de son pH : s = l(H3O+) [H3O+] + l(CH3COO-) [CH3COO-] avec [H3O+] =[CH3COO-] s =( l(H3O+) +l(CH3COO-)) [H3O+] = 15,5.10-3 S.m-1 [H3O+] =s /( l(H3O+) +l(CH3COO-))=15,5.10-3/(35,0 .10-3 +4,09 .10-3 )=0,396 mol m-3 = 3,96 10-4 mol/L pH= -log(3,96 10-4) = 3,40. Ecrire l'équation de la réaction chimique étudiée : CH3COOH + HCO3- = CO2 ,H2O+CH3COO- quantité de matière à l'état initial correspondant à 1,00 g d'hydrogénocarbonate de sodium : m / M = 1/84 = 1,2 10-2 mol.
si HCO3-en défaut, xmax =1,2 10-2 mol. retenir la plus petite valeur : xmax =3,7.10-5 mol. CH3COOH réactif limitant. valeur numérique de l'avancement final xf de cette réaction : la pression est P = 1,02 105 Pa ; la température T= 273+ q =273+ 25 =298 K ; le volume total de gaz dégagé par la réaction V= 0,89 mL =8,9 10-7 m3. xf = PV/(RT) =1,02 105*8,9 10-7 / (8,31*298)=3,7 10-5 mol taux d'avancement final t de cette transformation : xf / xmax =3,7 10-5 /3,7.10-5 = 1 La transformation chimique est donc totale.
|
|||||||||||||||||||||||||||||||||||||||||||||||
| |
||||||||||||||||||||||||||||||||||||||||||||||||
| |
||||||||||||||||||||||||||||||||||||||||||||||||
|
|