|
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptés à vos centres d’intérêts. |
||||||||||||||||
|
||||||||||||||||
|
|
A un volume V1 = 20,0 mL d'une solution S1 contenant des ions Cu2+, on ajoute une solution d'iodure de potassium (K+ (aq) + I - (aq) ) en excès. La transformation chimique est modélisée par : 2 Cu2+(aq) + 4 I- (aq) = 2 CuI(s) + I2 (aq) (1) Dans une seconde étape le diode formé I2(aq) est dosé par une solution de thiosulfate de sodium(2Na+(aq)+S2O32-(aq)) telle que [S2O32-(aq) ] = 0,40 mol.L-1. L' empois d'amidon ajouté. sert d'indicateur de fin de réaction, ce dernier donnant une teinte violette foncé en présence de diiode. Le volume équivalent de solution de thiosulfate de sodium ajouté vaut VE= 12,4 mL. Cette seconde transformation chimique est modélisée par : I2(aq) +2 S2O32-(aq) = S4O62-(aq) +2 I- (aq) (2) à l'équivalence, relation entre les quantités de diiode n(I2) et d'ions thiosulfate n( thio) : D'après le coefficients stoechiométriques de (2) : n( thio) = 2 n(I2) n(I2) = ½ n( thio) =0,5 VE[S2O32-(aq) ] Relation entre les quantités de diiode n(I2) et d'ions cuivre n(Cu2+) D'après le coefficients stoechiométriques de (1) n(Cu2+) = 2 n(I2 ) = VE[S2O32-(aq) ] concentration [Cu2+] de la solution S1 : V1[Cu2+]= VE[S2O32- (aq) ] [Cu2+]= n(Cu2+) / V1 = VE[S2O32-(aq) ] / V1 = 12,4*0,40/20= 0,25 mol/L.
Dosage spectrophotométrique , dosage par étalonnage : On prépare une échelle de teintes à partir d'une solution S0 de concentration c0= 0,50 mol.L-1. Les ions Cu2+(aq) sont responsables de la couleur bleue.
Description de la préparation de 50 mL de la solution S2 à partir de la solution mère S0 Facteur de dilution F= concentration mère / concentration S2 = c0/c2 = 0,5 / 0,2 = 2,5 Volume fiole jaugée / volume pipette = F d'où volume pipette = volume fiole jaugée / F= 50 / 2,5 = 20 mL Prélever 20 mL de la solution mère à la pipette jaugée + pipeteur Placer dans une fiole jaugée de 50 mL Compléter jusqu'au trait de jauge avec de l'eau distillée Boucher agiter pour rendre homogène.
Ainsi les mesures de l'absorbances des solutions bleues correspondront aux diverses concentrations de la seule espèce colorée, l'ion cuivre II. On mesure l'absorbance des solutions préparées.
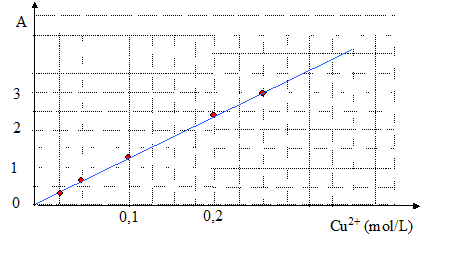
La courbe obtenue est une droite : la loi de Beer-Lambert A = k. [ Cu2+(aq) ] est donc vérifiée. Recherche du coefficient directeur de la droite ci-dessus : k= 3/0,25 = 12 L mol-1. A= 12 [ Cu2+(aq) ] Déterminer la concentration de la solution S1. 25,0 mL de cette solution sont introduits dans une fiole jaugée de 50 mL ; on complète avec de l'eau distillée jusqu'au trait de jauge. Le facteur de dilution est égal à F= 50/25 = 2. L'absorbance de cette solution S2 vaut A= 1,5. [ Cu2+(aq) ]S2 = A/12 = 1,5 /12 = 0,125 mol/L et en tenant compte du facteur de dilution ( F=2), la concentration de la solution S1 vaut : 2*0,125 = 0,25 mol/L.
|
|||||||||||||||
| |
||||||||||||||||
|
|