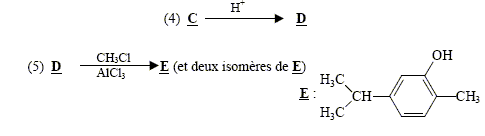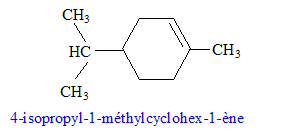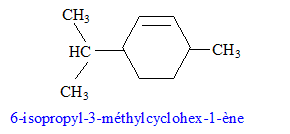|
Dosage pHmétrique d'une solution d'acide
phosphorique, radioactivité uranium, synthèse organique. |
|||
|
|||
|
|
Données (à 25 °C) : pK1 (H3PO4 / H2PO4-) = 2,1 ; pK2 (H2PO4- / HPO42-) = 7,2 ; pK3 (HPO42- / PO43- ) = 12,4 ; Produit ionique de l’eau à 25 °C : pKe = 14,0
corrigé 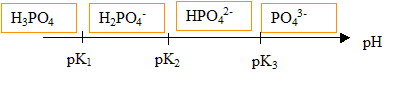
Le pH de la solution (S) est de 2,1, égal à pK1. Les espèces majoritaires issues de l'acide phosphorique dans (S) sont H3PO4 et H2PO4-, en quantités égales. Le coefficient de dissociation de l'acide phosphorique dans (S) est donc 50%. Étude de la première équivalence : l'espèce majoritaire est H2PO4- au point E1. cette espèce est un ampholyte, elle se comporte comme un acide ou comme une base. H2PO4- + H2O = HPO42-+ H3O+ ( comportement acide) K2 = [HPO42-][H3O+] / [H2PO4-] (1) H2PO4- +H3O+ = H3PO4 + H2O ( comportement basique) expression littérale du pH à la première équivalence E1 : pH= ½(pK1+pK2) = 0,5(2,1+7,2)=4,65. équation de la réaction de dosage entre E1 et E2 : H2PO4- +HO- = HPO42-+ H2O avec KR= [HPO42-]/ ([H2PO4-][HO-] ) (2) en tenant compte de (1) : KR=K2 / ([H3O+][HO-] ) = K2 / Ke = 10-7,2 / 10-14 = 106,8 = 6,3 106. Cette constante étant grande, la réaction est totale. Étude de la deuxième équivalence : espèce majoritaire qui impose le pH à la deuxième équivalence E2 : HPO42- pH2= ½(pK2+pK3) = 0,5(7,2+12,4)=9,8. équation de la réaction de dosage après la deuxième équivalence : HPO42- +HO- = PO43-+ H2O avec KR= [PO43-]/ ([HPO42-][HO-] ) (2) or HPO42- + H2O = PO43-+ H3O+ avec K3 = [PO43-][H3O+] / [HPO42- ] (3) en tenant compte de (3) : KR=K3 / ([H3O+][HO-] ) = K3 / Ke = 10-12,4 / 10-14 = 101,6 = 39,8. Cette constante étant assez faible, la réaction est partielle. Le saut de pH correspondant au dosage de la 3è acidité est faible : on ne peut pas doser la 3è acidité de l'acide phosphorique par suivi pHmétrique.
|
||
|
Données : Radium Ra ( Z= 88) ; Actinium Ac (Z=89) ; Thorium Th ( Z=90) ; Protactinium Pa (Z=91) ; Uranium U( Z=92) ; Neptunium Np(Z=93) ; Plutonium Pu (Z=94) L’uranium naturel est constitué de deux isotopes : 23892 U (majoritaire) et 23592 U (minoritaire). Tous les isotopes de l’uranium sont radioactifs. Les noyaux 23592 U sont fissiles, les noyaux 23892 U ne le sont pas.
corrigé Deux isotopes ne se différencient que par leur nombre de neutrons ; ils ont le même numéro atomique, le même nombre de protons. Un nucléide est fissile si son noyau, sous l'action de neutrons ( peut importe leur énergie) peut conduire à une fission. radioactif : qui a de la radioactivité ; noyau qui a la propriété de se désintégrer spontanément pour conduire à des particule a, b et à des rayonnements électromagnétiques g. Le noyau d’uranium 238 se désintègre en émettant une particule a : 23892 U -->AZ X+ 4 2He. conservation de la charge : 92=Z+2 soit Z = 90 et X est le Thorium Th conservation du nombre de nucléons : 238 = A+4 soit A = 234 période (ou demi-vie) T : durée au bout de laquelle la moitié des noyaux initiaux se sont désintégrés. expression la période T en fonction de la constante radioactive l : à t = T, N= ½N0. ½N0= N0 exp(-lT) ; 0,5 = exp(-lT) ; ln 0,5 = -lT ; lT = ln2 ; T = ln2 / l. équations des réactions nucléaires 1, 2 et 3 : Réaction 1 : un noyau d’uranium 23892 U peut capturer un neutron sans subir de fission pour donner un noyau X. 23892 U +01n-->23992
U 23992 U--> 23993Np+ 0-1e Réaction 3 : le noyau de neptunium est aussi radioactif b-. Il se transforme en un noyau de plutonium. 239 93Np = 23994Pu + 0-1e temps t99 au bout duquel 99 % des noyaux présents à l'instant initial, ont disparu : N = N0 exp(-lt), avec N/N0 =0,01 ; ln 0,99 = -l t = -ln2 t / T ; t = -T ln(0,01) /ln 2 = 6,64 T. Pour chacune des trois désintégrations successives (réactions 2, 3 et 4), calcul du temps t99 : (2) : t99 = 6,64*23 = 152,7 min ; (3) : t99 = 6,64*2,3 = 15,3 j ; (4) : t99 = 6,64*24000 = 1,59 105 années ; L'utilisation du plutonium nécessite une surveillance de son utilisation pendant des millénaires.
|
|||
|
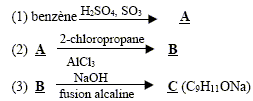
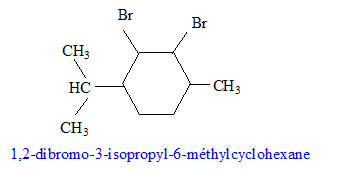
Dans la synthèse suivante, seul le produit organique principal est indiqué pour chaque réaction.
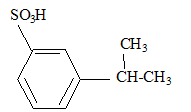
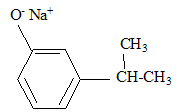
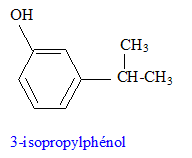
corrigé formules semi-développées des produits A, B et C. A : acide benzène sulfonique : F-SO3H Le substituant électroattracteur -SO3H appauvrit la densité électronique du noyau benzénique ; ce dernier est moins réactif ; Pour une seconde substitution, la position méta est la moins défavorisée. B : Pour réaliser une substitution électrophile, l'activation des halogénoalcanes est réalisée par un acide de Lewis AlCl3. La fusion alcaline conduit à un dérivé d'un phénol (phénate de
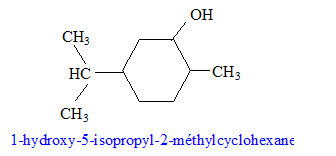
sodium) C : type de réaction auquel appartient la réaction (4) : acide base ; à partir de l'ion phénate on passe à l'acide conjugué, le phénol nom et la formule semi-développée du composé D : les formules semi-développées des composés F et G : L'alcool F est déshydraté, on obtient majoritairement l'alcène
le plus substitué ( règle de Zaïtsev) : formule semi-développée du composé G’, isomère de G : le test au dibrome sur G dans le tétrachlorure de carbone conduit à un dibromoalcane ( addition de Br2 sur la double liaison carbone-carbone : décoloration du dibrome )
|
|||
|
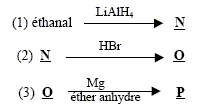
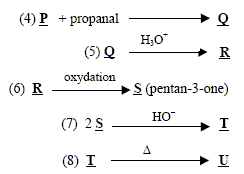
Un composé M de masse molaire 70,0 g.mol-1 possède la composition massique suivante : %C : 85,7 ; % H : 14,3. Masse atomique ( g/mol) : C : 12 ; H : 1,0 ; O : 16 .
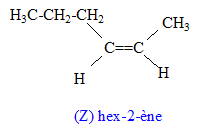
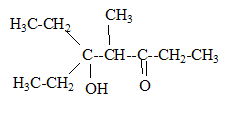
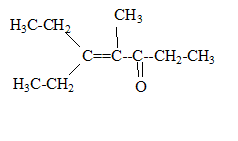
corrigé la formule brute de A : CxHy. 12x/85,7= 0,7 soit x= 5 ; y/14,3 = 0,7 soit y = 10 ; C5H10. L’ozonolyse de M suivie d'une hydrolyse en milieu réducteur conduit à deux composés : l’éthanal et le propanal. L'ozonolyse permet de déterminer la position de la liaison double carbone-carbone ( ici entre le carbone2 et le carbone3) CH3-CH=CH-CH2-CH2-CH3. (Z et E) hex-2-ène. Ce composé présente l'isomérie (Z- E) : le nom et la formule des composés N, O et P : L'éthanal conduit à l'éthanol par réduction de la fonction aldehyde N est CH3-CH2OH Substitution du groupe hydroxy -OH par Br ;O est : CH3-CH2Br bromoéthane. Puis passage à l'organomagnésien, instable en présence d'eau ( il donnerait l'éthane) ; P est CH3-CH2MgBr bromure d'éthylmagnésium formule semi développée des composés Q, R, S, T et U : un organomagnésien conduit en présence d'un aldehyde à un alcool secondaire R : CH3-CH2-CHOH-CH2-CH3 ( pentan-3-ol) Q est : CH3-CH2-CH[OMgBr]-CH2-CH3 L'oxydation ménagée de l'alcool secondaire donne une cétone : CH3-CH2-CO-CH2-CH3 ( pentan-3-one) nom d'un agent oxydant pouvant intervenir lors de la réaction (6) : MnO4- ion permanganate en milieu acide puis cétolisation en milieu basique : puis déshydratation ( crotonisation) d'autant plus facile que dans le produit les deux doules liaisons forment un système conjugué.
|
|||
|
|