|
pH et précipitation, pile et oxydoréduction, chimie organique. En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptés à vos centres d’intérêts. |
|||
|
|||
|
|
Produits de solubilité : Ks (Fe(OH)2) = 4,9 × 10-17 ; Ks (Fe(OH)3) = 2,8 × 10-39 ; Produit ionique de l’eau : Ke = 1,0 × 10-14 à 25°C ; Constante d’acidité de l’acide éthanoïque : Ka (CH3COOH/CH3COO-) = 1,7 × 10-5.
corrigé configuration électronique du fer : 26 électrons répartis suivant 2 électrons au niveau n=1; 8 électrons au niveau n=2 ; 14 électrons au niveau n=3 ; 2 électrons au niveau n=4 soit 1s2 2s2 2p6 3s2 3p6 3d6 4s2. Le fer appartient à la première série des métaux de transition : colonne n°8 de la classification ; ligne ( période) n°3 hydroxyde de fer II : Fe(OH)2 en équilibre avec Fe2+ + 2HO- Ks =[Fe2+] [HO-]2 avec [Fe2+] =0,100 mol/L et Ks (Fe(OH)2) = 4,9 × 10-17 d'où [HO-]2 = Ks /[Fe2+] = 4,9 × 10-16 ; [HO-] = 2,2 10-8 mol/L ; [H3O+]= 10-14 / 2,2 10-8 = 4,51 10-7 soit pH= -log (4,51 10-7 ) = 6,34. hydroxyde de fer III : Fe(OH)3 en équilibre avec Fe3+ + 3HO- Ks =[Fe3+] [HO-]3 avec [Fe3+] =0,020 mol/L et Ks (Fe(OH)3) = 2,8 × 10-39 d'où [HO-]3 = Ks /[Fe3+] =2,8 × 10-39 /0,02 =1,4 10-37 ; [HO-] = 5,19 10-13 mol/L [H3O+]= 10-14 / 5,19 10-13 = 1,92 10-2 soit pH= -log (1,92 10-2 ) = 1,71. Le précipité Fe(OH)3 apparaît en premier dès pH= 1,71 tandis que Fe(OH)2 commence à apparaître dès que le pH atteint la valeur 6,34. Dans l’intervalle de pH [1,71 ; 6,34 ] un seul précipité est présent. volume V d’une solution d’éthanoate de sodium à 1,00 mol.L-1 à verser dans un volume V0 égal à 500 mL de solution d’acide éthanoïque à 0,500 mol.L-1 pour obtenir une solution tampon de pH = 4,5. pH=pKa + log ([CH3COO-]/[CH3COOH]) avec pKa = -log 1,7 × 10-5 = 4,77 et pH= 4,5 d'où log ([CH3COO-]/[CH3COOH]) =4,5-4,77 = -0,27 ; [CH3COO-]/[CH3COOH] = 0,537. Quantité de matière d'acide : n0= 0,5*0,5 = 0,25 mol ; concentration finale de l'acide dans la solution [CH3COOH]f=0,25/(0,5+V) Quantité de matière d'éthanoate de sodium : n= V mol ; concentration finale de l'éthanoate de sodium dans la solution [CH3COO-]f=V/(0,5+V) d'où V/0,25 = 0,537 soit V= 0,134 L.
|
||
|
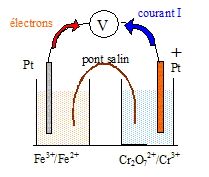
Données à 25 °C. Potentiels redox standard : Cr2O72-/Cr3+ : 1,33 V ; Fe3+/Fe2+: 0,77 V On considère une solution S à 1,0 × 10-1 mol.L-1 en sulfate de fer (II) et 2,0 × 10-2 mol.L-1 en chlorure de fer (III), suffisamment acidifiée pour qu’aucun précipité n’apparaisse.
corrigé demi-pile n°1 : Fe3++ e-=Fe2+ ; E1 = 0,77 + 0,06 log ([Fe3+] /[Fe2+]) =0,77 +0,06 log(0,02/0,1) = 0,73 V. demi-pile n°2 : Cr2O72- + 14H+ + 6e- = 2Cr3+ + 7H2O ; E2 = 1,33 + 0,06/6 log([Cr2O72-][H+]14/[Cr3+]2) [H+] = 0,1 mol/L ; E2 = 1,33 + 0,01 log (10-3 *10-14/ 10-2) = 1,18 V. E2 >E1, la demi pile n°2 constitue le pôle positif de la pile
fem de la pile : E= E2-E1 = 1,18-0,73 = 0,45 V. Equation de la réaction de la transformation qui se produit dans la pile lorsqu’elle débite : Cr2O72- + 14H+ + 6e- = 2Cr3+ + 7H2O 6 Fe2+ = 6 Fe3+ + 6 e- Cr2O72- + 14H+ +6 Fe2+ = 6 Fe3+ +2Cr3+ + 7H2O ; K = [Fe3+]6[Cr3+]2/([Cr2O72-][H+]14[Fe2+]6). E°2-E°1 = RT/nF ln K = ; 1,33-0,77 = 8,31*298 / (96500 *6) ln K ; 0,56 = 4,28 10-3 lnK ; ln K= 130,93 ; K= 7,3 1056. quotient de réaction initial Qr,i = [Fe3+]i6[Cr3+]i2/([Cr2O72-]i[H+]i14[Fe2+]i6) Qr,i =0,026*0,01/(10-3*10-14*10-6)=6,4 1010. Qr,i < K donc évolution dans le sens direct, de la gauche vers la droite. valeur du quotient de réaction lorsque la pile s’arrêtera de fonctionner : Qr = K
|
|||
|
Pour synthétiser la dibenzylidène acétone ou 1,5-diphénylpenta-1,4-diène-3-one, notée X, on fait réagir le benzaldéhyde avec un composé A dont on va déterminer la structure.
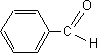
corrigé la formule brute de A : CxHyOz : 12x/62,1 = 0,58 soit x= 3 ; y/10,3 = 0,58 soit y = 6 ; 16 z /27,6 = 0,58 soit z = 1 ; C3H6O. La réaction du diiode en milieu basique avec A conduit à l’apparition d’un précipité jaune. (réaction haloforme mettant en évidence le groupe -CO-CH3 d'une cétone a méthylée) CHI3 : iodoforme ou triodométhane. A est la propanone CH3-CO-CH3. CH3-CO-CH3+ 3 I2 +4 HO- --> CH3-COO-+ CHI3+3 I- + 3H2O formule semi-développée du benzaldéhyde : C6H5-CHO
formule semi-développée de Y : équations des deux réactions mises en jeu : 2 C6H5- CHO + CH3-CO-CH3 = Y puis Y = X + 2 H2O nom de la réaction de A avec le benzaldéhyde, conduisant à Y : cétolisation X existe sous plusieurs formes stéréoisomères :
|
|||
|
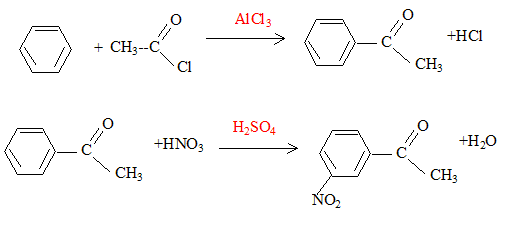
La synthèse de la 4-nitroacétophénone constitue le début de la synthèse d’un antibiotique puissant : le chloramphénicol. Malheureusement, la synthèse de la 4-nitroacétophénone est beaucoup moins directe que celle de son isomère, la 3-nitroacétophénone. 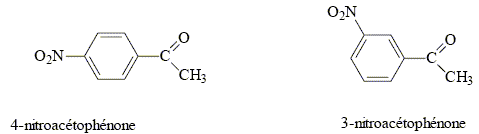
corrigé type d’isomérie existant entre ces deux molécules : isomérie de position.
L’ordre des étapes proposées n'a pas d' importance : les deux
groupes orientent en méta. équation de la réaction (1) : C6H6 + CH3Cl --> C6H5-CH3 + HCl ; le catalyseur est AlCl3. formule semi-développée et le nom du composé B : acide
4-nitrobenzoïque 5fois { R-CH3 + 2H2O = RCOOH + 6H+ + 6e-} 6MnO4- +5R-CH3 +18H+=
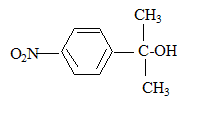
6Mn2+ + 5RCOOH+14H2O solvant à utiliser lors de la préparation de l’organomagnésien CH3MgBr : ether anhydre (solvant anhydre et non protique) formule semi-développée de D :
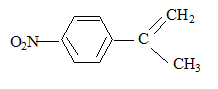
formule semi-développée de F : H2C=O ; le zinc évite l'oxydation de l'aldehyde en acide carboxylique.
|
|||
|
|
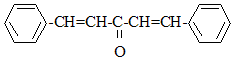
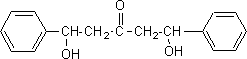
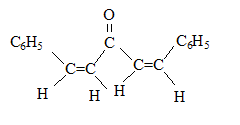 (1Z,4Z)-1,5-diphénylpenta-1,4-diène-3-one
(1Z,4Z)-1,5-diphénylpenta-1,4-diène-3-one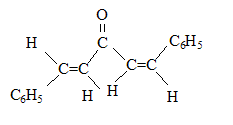 (1E,4Z)-1,5-diphénylpenta-1,4-diène-3-one
(1E,4Z)-1,5-diphénylpenta-1,4-diène-3-one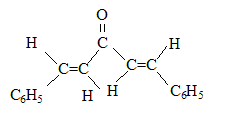 (1E,4E)-1,5-diphénylpenta-1,4-diène-3-one
(1E,4E)-1,5-diphénylpenta-1,4-diène-3-one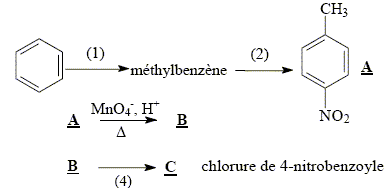
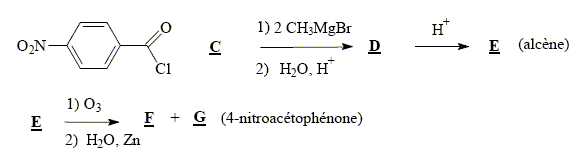
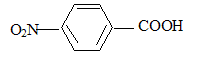 (
noté ensuite R-COOH)
(
noté ensuite R-COOH)