|
d'après bac S Asie 2006 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptés à vos centres d’intérêts. |
|||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||
|
|
Données: pKa des couples acide / base : Acide méthanoïque HCOOH(aq) / ion méthanoate HCOO -(aq) : pKa1 = 3,8 Acide benzoïque C6H5COOH (aq) / ion benzoate C6H5 COO -(aq) : pKa2 = 4,2 I- Étude de solutions aqueuses d'acide méthanoïque et d'acide benzoïque de même concentration : On dispose de solutions aqueuses d'acide méthanoïque et d'acide benzoïque de même concentration molaire en soluté apporté c = 1,0 10- 2 mol/L. La mesure du pH d'un volume V = 10 mL de chaque solution fournit les résultats suivants : - solution aqueuse d'acide méthanoïque : pH1 = 2,9 ; - solution aqueuse d'acide benzoïque : pH2 = 3,1.
II- Évolution d'un système chimique : Soit la réaction chimique suivante : HCOOH (aq) + C6H5 COO -(aq) = HCOO -(aq) + C6H5COOH (aq)
corrigé Étude de solutions aqueuses d'acide méthanoïque et d'acide benzoïque de même concentration : Equation de la réaction de l'acide méthanoïque avec l'eau : HCOOH (aq) + H2O = HCOO -(aq) +H3O+(aq) L'avancement maximal vaut : xmax = Vc = 10-2*10-2 = 1,0 10-4 mol. L'avancement final vaut : xfin = V 10-pH1 = 10-2 *10-2,9 = 1,3 10-5 mol. Le taux d'avancement final vaut t =xfin / xmax =1,3 10-5 / 10-4 =0,13 je conclus : le taux d'avancement final étant inférieur à 1, la transformation chimique mettant en jeu la réaction de l'acide méthanoïque avec l'eau est donc limitée. pour quel acide la réaction avec l'eau est-elle la plus avancée ? Le taux d'avancement final s'exprime par : t = xfin / xmax = V 10-pH /(Vc) = 10-pH / c D'une part les concentrations des deux solutions sont identiques, d'autre part le pH de la solution d'acide benzoïque est supérieur au pH de la solution d'acide méthanoïque ; de plus 10-pH est une fonction décroissante du pH : en conséquence la solution qui a le plus petit pH( l'acide méthanoïque) correspond à l'acide pour lequel la réaction avec l'eau est la plus avancée. Évolution d'un système chimique : Soit la réaction chimique suivante : HCOOH (aq) + C6H5 COO -(aq) = HCOO -(aq) + C6H5COOH (aq) Expression de la constante d'équilibre de cette réaction : K= [HCOO -][C6H5COOH]/ ([C6H5 COO -][HCOOH]) (1) d'une part : HCOOH (aq) + H2O = HCOO -(aq) +H3O+(aq) ; Ka1 = [HCOO -][H3O+] / [HCOOH]) (2) d'autre part : C6H5COOH (aq) + H2O = C6H5 COO - (aq) +H3O+(aq) ; Ka2 = [C6H5 COO -][H3O+] / [C6H5COOH]) (3) (2) divisé par (3) donne (1) soit K= Ka1 / Ka2 = 10-3,8 / 10-4,2 = 100,4 = 2,5. quotient de réaction dans l'état initial : Qr i= [HCOO -]i[C6H5COOH]i / ([C6H5 COO -]i [HCOOH]i ) avec [HCOO -]i = [C6H5COOH]i = 0,25 c' ( en tenant compte de la dilution lors du mélange) et [C6H5 COO -]i = [HCOOH]i = 0,25 c Qr i=c'²/c² = (5,0 10-3 / 1,0 10-2 )² = 0,5² = 0,25. Qr i<K, le critère d'évolution spontané, indique une évolution dans le sens direct, de la gauche vers la droite. valeur de c' pour que le système soit en équilibre : si Qr i = K , le système est à l'équilibre soit c'²/c² =2,5 d'où c'² =2,5 c² ; c'=2,5½ c = 1,6 10-2 mol/L.
|
||||||||||||||||||||||||||
|
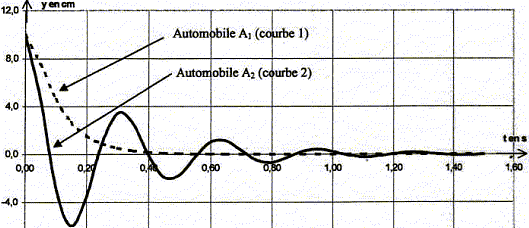
Les parties 1 et 2 de cet exercice sont indépendantes I- La suspension : les amortisseurs : (4 pts) La suspension d'une automobile permet d'atténuer les oscillations verticales, inconfortables et dangereuses pour les passagers, se produisant lors du passage dans un trou ou sur un obstacle. Elle se compose au niveau de chaque roue d'un ressort et d'un amortisseur (généralement à huile). Pour étudier ce système, l'automobile est modélisée par un solide de masse m, de centre d'inertie G reposant sur un ressort vertical de constante de raideur k. Le repérage des positions y du centre d'inertie de l'automobile se fait selon un axe vertical Oy orienté vers le haut ; l'origine O est choisie à la position d'équilibre G0 du centre d'inertie du solide. Les amortisseurs engendrent globalement une force de frottement opposée au vecteur vitesse du solide et proportionnelle à sa valeur ; le coefficient de proportionnalité h s'appelle coefficient d'amortissement. 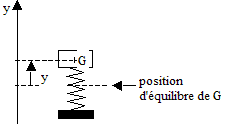
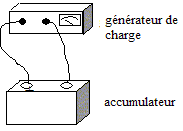
II- L'alimentation électrique: l'accumulateur au plomb : La batterie de démarrage d'une automobile est constituée par l'association, en série, de plusieurs éléments d'accumulateurs au plomb. Un élément d'accumulateur comprend deux électrodes : l'une est en plomb métal Pb(s), l'autre est recouverte de dioxyde de plomb PbO2(s). Elles sont immergées dans une solution aqueuse d'acide sulfurique. Les deux couples oxydant / réducteur impliqués dans le fonctionnement de cet accumulateur sont : PbO2(s) / Pb2+ (aq) et Pb2+ (aq) / Pb(s).
corrigé La suspension : les amortisseurs : Expression correcte de la période propre T0
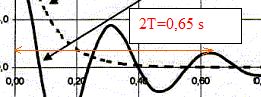
de l'oscillateur : analyse dimensionnelle 2p est sans dimension ; masse : [m]= M ; [T0]= T D'une part, la valeur de la tension d'un ressort est proportionnelle à sa déformation x ; le coefficient de proportionalité est la raideur k : en conséquence k est égal à une force divisée par une longueur . k = F/x D'autre part, la seconde loi de Newton indique qu'une force est égale à une masse multipliée par une accélération : F= ma De plus une accélération est une longueur divisée par un temps élevé au carré . en conséquence, la dimension de k est : [k]= [ma/x]= MLT-2 L-1 = MT -2 dimension de k/m : [k/m]= MT-2 M-1 = T-2 ; soit [k/m]½=T-1 ; je conclus : T0 = 2p(k/m)½ ne convient pas. dimension de m/k : [m/k]= M-1 T 2 M = T2 ; soit [m/k]½=T ; je conclus : T0 = 2p(m/k)½ convient. dimension de km : [m/k]= MT -2 M =M2 T -2; soit [mk]½=MT-1 ; je conclus : T0 = 2p(mk)½ ne convient pas. Les oscillations sont libres : au delà de la bosse, le ressort n'est pas sollicité par un excitateur A la courbe 1 correspond un régime apériodique ( on n'observe pas d'oscillation) ; à la courbe 2 on associe un régime pseudopériodique ( l'amplitude des oscillation diminue au cours du temps). Détermination graphique de la pseudo-période :
T voisin de 0,325 s soit 0,32
s. d'une part T voisin T0 = 0,33 s et d'autre part :T0 = 2p(m/k)½ soit T²0 = 4p² m/k : m = kT²0 / (4p² ) m = 6,0 105 * 0,325² / (4*3,14²) =1,6 103 kg. Les allures différentes des courbes sont dues au coefficient d'amortissement h : l'amortissement est d'autant plus grand que le coefficient d'amortisement h est grand : donc la courbe 1 correspond à la plus grande valeur de h. Une bonne suspension correspond à un coefficient d'amortissement grand : les passagers ne doivent pas être soumis à des oscillations à chaque passage de bosse. "il impose à la roue testée une excitation verticale " : en conséquence, lors de ces tests les amortisseurs sont soumis à des oscillations forcées. L'amplitude des oscillations passe par un maximum pour une
fréquence voisine de la fréquence propre, caractéristique de
l'amortisseur : ce phénomène porte le nom de résonance.
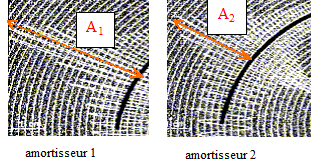
A2 <A1, donc l'amortisseur 2 assure le meilleur confort. L'alimentation électrique: l'accumulateur au plomb : Lors de la décharge, l'accumulateur joue le rôle de générateur. couple :PbO2(s) / Pb2+ (aq) ; l'oxydant PbO2(s) se réduit : PbO2(s) + 4 H+ (aq) + 2e- = Pb2+ (aq)+ 2 H2O( l) ( 1) . couple : Pb2+ (aq) / Pb(s) ; le réducteur Pb(s) s'oxyde : Pb(s) = Pb2+ (aq)+ 2e- ( 2) . Des électrons porteurs d'une charge négative sont libérés lors de cette oxydation, en conséquence cette électrode de plomb constitue la borne négative de ce générateur. ( 1) + ( 2) conduisent à l'équation de la réaction : PbO2(s) + 4 H+ (aq) + Pb(s) = 2 Pb2+ (aq) + 2 H2O( l) masse de plomb Pb(s) consommée : Le fonctionnement du démarreur nécessite un courant d'intensité 200 A. Le conducteur actionne le démarreur pendant 1,0 s ; en conséquence la quantité d'électricité Q mise en jeu est : Q=It = 200*1 = 200 C. Or Q= n(e-) F : avec F, le faraday : 1F = NA e et n(e-) : quantité de matière (mol) d'électrons d'où : n(e-) = Q/(NA e) De plus : Pb(s) = Pb2+ (aq)+ 2e- d'où : n(e-) = 2 n(Pb) soit n(Pb) = ½ n(e-) enfin m(Pb) = n(Pb) M(Pb) par suite la masse de plomb disparue s'exprime par : m(Pb) = ½QM(Pb) / (NA e) m(Pb) = 0,5*200 *207,2 / ( 6,02 1023 *1,6 10-19)=0,21 g. Lors de la charge, l'accumulateur joue le rôle d'électrolyseur : le sens du courant est imposé par le générateur de charge. en conséquence la transformation est forcée, l'accumulateur reçoit de l'énergie électrique de la part du générateur de charge. L'équation de la réaction chimique se produisant lors de la charge est l'inverse de la réaction chimique de décharge. 2 Pb2+ (aq) + 2 H2O( l) = PbO2(s) + 4 H+ (aq) + Pb(s)
|
|||||||||||||||||||||||||||
|
On soumet à un flux de neutrons lents un échantillon d'argent ne contenant que des atomes d'argent 107. Un noyau d'argent 107 capte un neutron et il se forme un noyau d'argent 108. Le noyau d'argent 108 est radioactif. Il se désintègre suivant plusieurs processus compétitifs dont la radioactivité b - et la radioactivité b+. Donnée: extrait de la classification périodique fournissant les symboles des éléments et leur numéro atomique Rh : Z = 45; Pd : Z = 46 ; Ag : Z = 47 ; Cd : Z = 48 ; In :Z = 49 I- Capture d'un neutron :
II- Désintégration du noyau d'argent 108 :
III- Activité d'un échantillon de noyaux d'argent 108 : On considère un échantillon contenant N0 noyaux d'argent 108 à l'instant de date t = 0 s. Soit N, le nombre de noyaux restant à l'instant de date t.
IV- Demi-vie radioactive de l'argent 108 : On se propose de déterminer expérimentalement la demi-vie de l'argent 108. On s'inspire des résultats théoriques de la question 3 et on mesure le nombre n1 de désintégrations obtenues pendant la durée D t = 0,50 s. Cette mesure se répète toutes les 20 s. Les résultats sont rassemblés dans le tableau ci-dessous.
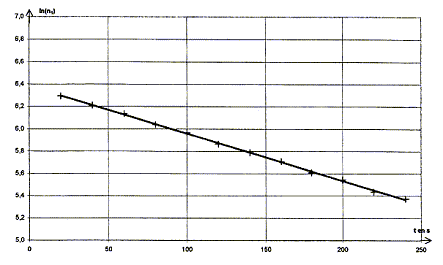
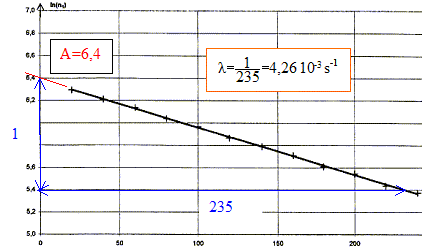
corrigé Capture d'un neutron : équation de la réaction de capture d'un neutron par un noyau d'argent 107 : 10747Ag + 10n = 10847Ag conservation du nombre de nucléons : 107+1 = 108 conservation de la charge : 47+0=47 Désintégration du noyau d'argent 108 : Les particules émises au cours des radioactivités b - et b+ sont respectivement un électron 0-1e et un positon 01e. équations correspondant à chacune des transformations radioactives pour l'argent 108 : 10847Ag = AZX + 0-1e la conservation du nombre de nucléon impose A= 108 ; la conservation de la charge conduit à : Z=48, élément cadmium Cd 10847Ag = AZX + 01e la conservation du nombre de nucléon impose A= 108 ; la conservation de la charge conduit à : Z=46, élément palladium Pd Activité d'un échantillon de noyaux d'argent 108 : On considère un échantillon contenant N0 noyaux d'argent 108 à l'instant de date t = 0 s. Soit N, le nombre de noyaux restant à l'instant de date t. la demi-vie radioactive t1/2 est la durée au bout de laquelle la moitié des noyaux initiaux se sont désintégrés. l t1/2 =ln2 ; ln2 étant sans dimension, en conséquence l est l'inverse d'un temps : [l]= T-1. l s'exprime en s-1. Expression de n1 en fonction de Dt, N0, t et l : d'une part A = -dN/dt et N= N0 exp(-lt) d'où : A= N0 lexp(-lt) = l N d'autre part : A = n1 / Dt en conséquence : n1 / Dt = N0 lexp(-lt) soit n1 = Dt N0 l exp(-lt) ln(n1) = ln(Dt N0 l) - lt Demi-vie radioactive de l'argent 108 : ln(n1) = ln(Dt N0 l) - lt : ln(Dt N0 l) est une constante ; l est également une constante positive ( -l négatif) : donc ln(n1) = A+Bt, fonction affine décroissante: La représentation graphique est en accord avec la relation ln(n1) = ln(Dt N0 l) - lt
ln(Dt N0 l) =A = 6,4 avec Dt = 0,5 s Dt N0 l = e6,4 ; N0 = e6,4 /(Dt l ) = e6,4 /(0,5*4,26 10-3)=2,8 105 noyaux. Or l t1/2 = ln2 soit t1/2 =ln2 / l = ln2 / 4,26 10-3 = 163 s.
|
|||||||||||||||||||||||||||
| |
|||||||||||||||||||||||||||
|
|