|
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptés à vos centres d’intérêts. |
||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
La réaction étudiée met en jeu l'acide éthanoïque de formule CH3-COOH et un alcool, le propan-1-ol ( CH3-CH2-CH2OH ) ; on obtient un ester de formule CH3COO-CH2-CH2-CH3 et de l'eau. La réaction modélisant la transformation s'écrit : CH3-COOH + CH3-CH2-CH2OH = CH3COO-CH2-CH2-CH3 + H2O Les principales caractéristiques d'une réaction d'estérification sont : lente, athermique, limitée par l'hydrolyse de l'ester. Le protocole : On place dans un becher ( placé dans un bain d'eau glacé ) 0,38 mol d'acide éthanoïque et 0,38 mol d'alcool (propan-1-ol)), quelques gouttes d'acide sulfurique concentré. Le volume de ce mélange est :V= 50 mL. Agiter, répartir ce mélange en 10 fractions de volume V0 = 5 mL. Les tubes à essais sont numérotés de 0 à 9. Le tube n°0 est laissé dans la glace, tandis que les autres, munis d'un réfrigérant à air, sont placés dans un bain dont la température est constante, 60 °C. Un chronomètre est déclenché. Toutes les deux minutes, l'un des tubes est sorti , puis placé dans un bain d'eau glacé. Les ions oxonium H3O+ ( issus de l'acide sulfurique et l'acide éthanoïque ) restant sont dosés par une solution d'hydroxyde de sodium (soude): cela permet de déterminer la quantité d'acide éthanoïque restant dans chaque tube. rôle joué par l'acide sulfurique : catalyseur de l'estérification et de la réaction, l'hydrolyse de l'ester. rôle du bain thermostaté à 60 °C : la température est un facteur cinétique ; à 60 °C la vitesse de la réaction est plus grande qu'à 20 °C, température de la salle. rôle du bain glacé avant dosage des ions oxonium restant : blocage cinétique. A chaud, l'ester formé subirait une hydrolyse basique , lente mais totale, suivant : CH3COO-CH2-CH2-CH3 +HO- = CH3COO- + CH3-CH2-CH2OH
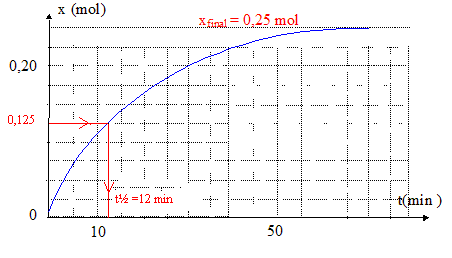
Le graphe suivant représente l'avancement x en fonction du temps : il permet de déterminer l'avancement final, le temps t½ de demi-réaction, date au bout de laquelle l'avancement vaut 0,5 xfinal.
le taux d'avancement de cette réaction est t = xfinal / xmax = 0,25/0,38 = 0,66 (66%) Etat d'équilibre : CH3-COOH + CH3-CH2-CH2OH = CH3COO-CH2-CH2-CH3 + H2O ; la constante de réaction K vaut K= 3,7. Expression de K : K= [CH3COO-CH2-CH2-CH3]éq [ H2O]éq / ([CH3-CH2-CH2OH]éq[CH3-COOH]éq) La composition du mélange à l'instant t½ est :
Qr t½ = [CH3COO-CH2-CH2-CH3]t½ [ H2O]t½ / ([CH3-CH2-CH2OH]t½[CH3-COOH]t½) Qr t½ =(0,125 / 0,255)2 = 0,24 Qr t½ <K, donc l'équilibre n'est pas encore atteint ; la composition du mélange évolue jusqu'à ce que le quotient de réaction atteigne la valeur de la constante d'équilibre. Au bout d'une heure le système chimique est en équilibre dynamique : le quotient de réaction est égal à la constante d'équilibre ; la composition du mélange ne change plus ; durant la même durée, il se forme autant d'ester par la réaction directe, qu'il n'en disparaît par la réaction inverse, l'hydrolyse.
|
|||||||||||||||||||||||||||||||||||||||||||||||||
| |
||||||||||||||||||||||||||||||||||||||||||||||||||
|
|