L'acide chlorhydrique réagit sur le zinc en donnant du dihydrogene et une solution de chlorure de zinc (II)
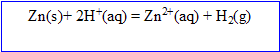
A t=0, on introduit m=1.0 g de zinc (M(zinc) = 65,4 g/mol) en poudre dans un ballon contenant v =40 mL d'une solution d'acide chlorhydrique de concentration C= 0.050 mol/L.
On recueille le gaz dihydrogene formé au cours du temps et on en mesure son volume V(H2), d'ou le tableau suivant :
| t(min) | 0 | 1 | 2 | 3 | 4 | 5 |
| V(H2) mL | 0 | 6,3 | 9,9 | 12,0 | 13,5 | 14,2 |
1/ Calculer la quantité de matière de dihydrogène n(H2) sachant que le volume molaire vaut : Vm=24 L/mol

2/Exprimer l'avancement x(t) en fonction de V(H2) et du volume molaire Vm.
Quantités de matière initiales des réactifs :

n( ion oxonium) = 0,05*40 =
mmol.
n( zinc) = 1/65,4 = 0,015 mol =
mmol
| avancement (mmol) | 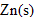 | +2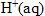 | =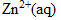 | +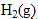 |
| initial | 0 | 1/65,4 =0,015 mol = 15 mmol | 0,05*40 = 2 mmol | 0 | 0 |
| en cours | X | 15-X | 2-2X | X | X= V(H2) / Vm |
| fin | Xmax | 15-Xmax | 2-2Xmax | Xmax | Xmax |
Si le zinc est en
: 15-Xmax=0 soit Xmax =
mmol
Si l'acide est en défaut : 2-2Xmax=0 soit Xmax =
mmol
On retient la plus
valeur : Xmax = 1 mmol.
3/ Exprimer les quantités de matiere des différents constituants en fonction de V(H2).
Avancement X = V(H2)/Vm avec V(H2) en mL et Vm =24 L/mol
Zinc restant à la date t : 15-
= 15-V(H2)/24
ion oxonium restant à la date t : 2-
= 2-2V(H2)/24 = 2-V(H2)/12
ion zinc formé à la date t :
= V(H2)/24
dihydrogène formé à la date t :
=V(H2)/24
4/ Déterminerà la date t=3 min, la composition ( en quantité de matiere) du mélange reactionnel. En deduire la concentration en ions zinc (II) dans la solution.
Dans les expressions ci-dessus remplacer V(H2) par 12 mL ou X par 0,5 mmol
n(zinc)= 15-0,5 =
mmol
n( ion oxonium) = 2-2*0,5=
mmol
n(ion zinc) = 0,5 mmol
n(H2) = 0,5 mmol
concentration en ion zinc = Qté de matière (mmol) / volume de la solution (mL) = 0,5 / 40 =
mol/L
5/ Pour quelle date V(H2)(t) est il égal à 8.0 mL ? En déduire la composition du mélange réactionnel à cet instant.
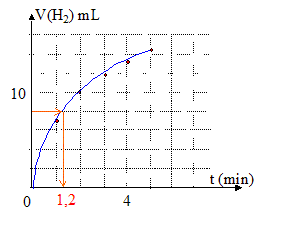
Dans les expressions ci-dessus remplacer V(H2) par 8 mL ou X par 8 /24 =0,33 mmol
n(zinc)= 15-0,33= 14,7 mmol
n( ion oxonium) = 2-2*0,33=
mmol
n(ion zinc) = 0,33 mmol
n(H2) = 0,33 mmol