Déterminer la masse volumique du chlorure d’hydrogène gazeux (à 25,0°C et sous une pression de 1,00 bar) assimilé à un gaz parfait . On donne M(HCl) = 36,5 g/mol ; R= 8,31 SI.
Le chlorure d’hydrogène est très soluble dans l’eau. On dissout 5,0 L de ce gaz dans 1,0 litre d’eau dans les mêmes conditions de température et pression. Le chlorure d'hydrogène est entièrement ionisé. Quelles sont les ions contenus dans la solution obtenue ? Calculer leur concentration et le pH de la solution.
On prélève 10,0 mL de la solution. Quel volume d’une solution d’hydroxyde de sodium à 0,100 mol/L faut-il ajouter pour atteindre l’équivalence ?

Si n= 1 mol, le volume du gaz est égal au volume molaire noté Vm.
P= 10 exposant Pa ; T= +25 = 298 K.
Vm = RT / P = 8,31*298* 10 exposant -5 =2,48 10 exposant -2 mètre cube = L.
La masse d'une mole de chlorure d'hydrogène HCl est : 1+35,5 = g = 3,65 10 exposant -2 kg.
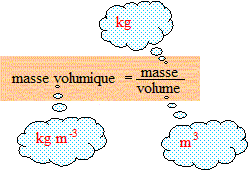
3,65 10^-2 / 2,48 10^-2 = 3,65/2,48 = 1,47 kg/m3 = 1,47 .
Les ions contenus dans la solution obtenue sont :
l'ion :  (aq)
(aq)
l'ion :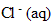

n( HCl)= n ( ion chlorure) = n( ion oxonium) = 5/24,8 = mol.
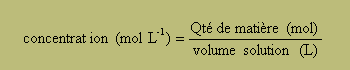
concentration : |ion chlorure]=[ion oxonium]= 0,20/1 = 0,20 mol/L.
pH= - log [ion oxonium]= - log 0,20 = .
Titrage acide base :
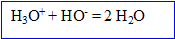
A l' les quantités de matière de réactifs sont en proportions stoéchiomètriques.

Quantité de matière d'ion oxonium : 0,20*10 = 2 mmol
Quantité de matière d'ion hydroxyde : 2= Cb Vb soit Vb = 2/Cb = 2/0,1 = mL.