L’étamage, réalisé par électrolyse, consiste à recouvrir une pièce métallique avec de l’étain. Les électrodes sont la pièce métallique et une barre d’étain. L’électrolyte est un bain d’ions 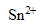 ( aq) .
( aq) .
Certaines boites de conserve sont fabriquées avec du fer blanc recouvert d’étain.
On étame une boite de conserve de surface totale S = 476 cm² ; la masse du dépôt est égale à 0,500 g par m² d’acier. L’intensité du courant d’électrolyse est I = 2,0 A. Donnée : F = 96500 C/mol
a) Quel rôle joue la boîte à étamer, anode ou cathode ?
b) Quelle est la masse d’étain à déposer ?
c) Quelle est la durée de l'électrolyse ? Masse molaire étain : 119 g/mol
d ) L'électrolyse est-elle une réaction spontanée ?
Le mot "cathode" est associé à "" .
Les ions 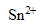 ( aq) se réduisent à la .
( aq) se réduisent à la .
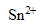 ( aq) +
( aq) + 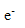 = Sn( solide)
= Sn( solide)
Le métal étain se dépose sur la boîte d'acier.
Surface totale de la boîte en m² : 1 m² = cm² ou 1cm² = 10 exposant m²
S= 476 cm² = 4,76 exposant m².
masse d'étain à déposer : * 4,76 10 exposant -2 =2,38 10 exposant -2 g = 23,8 mg.
Quantité de matière d'étain () : masse (g) / masse molaire (g/mol)
n= 2,38 10 exposant -2 / =2 10 exposant -4 mol
Or 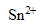 +
+ 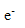 = Sn(s) ;
= Sn(s) ;
Quantité de matère d'électrons : 10 exposant -4 mol.
Quantité d'électricité ( ) =96500* Qté de matière d'électrons (mol = 96500*4 10 exposant -4 =9,65*4 = C.
Quantité d'électricité (C)= intensité () * durée ()
d'où durée= 38,6 / 2 = 19,3 s.
Une électrolyse est une réaction nécessitant un apport d'énergie sous forme d'énergie électrique.