Pour doser l'azote dans un engrais, on introduit 1,0 g de cet engrais dans un ballon à moitié rempli d'eau distillée, on ajoute ensuite de la soude caustique et
on distille. On recueille les vapeurs ammoniacales dans une solution contenant 20 mL d'acide sulfurique N.
Après distillation, on titre l'excès d'acide par NaOH à 1,0 mol/L en présence de méthylorange.
On utilise à cet effet, 6,2 ml de NaOH.
Calculez la teneur en azote de l'engrais. N : 14 g/mol
acide sulfurique N signifie : la concentration en ion de la solution est 1,0 mol/L
Réaction se produisant dans le ballon entre la soude et les ions ammonium :

Réaction entre les vapeurs ammoniacales et l'acide sulfurique :

Quantité de matière initiale d'ion oxonium dans 20 mL d'acide sulfurique :

N0= 1*0,020 = mol
Avec la soude, on a neutralisé l'excès d'acide sulfurique en :
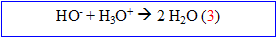
A l' du dosage acide base, les quantités de matière des réactifs sont en proportion stoéchiométriques :
Quantité de matière d'acide en excès : N1= concentration soude ( mol/L) fois volume (L) soude à l'équivalence
N1 = 1,0 * 6,2 10 exposant = 6,2 10^ -3 mol
On peut en déduire la quantité d'acide utilisé : N0-N1 = 0,020 -6,2 10^ -3 =0,0138 arrondi à mol
D'après (2) on en déduit la quantité de matière d'ammoniac, et d'ion ammonium : 0,014 mol dans 1 g d'engrais.
On a donc dans 1g d'engrais : 0,014 mole d'atome d'azote
Soit en masse :

14*0,0138 = g d'azote dans un gramme d'engrais ou 19 %.