L'étiquette d'une bouteille contenant une solution S incolore est partiellement détruite, on lit seulement "....de potassium; C=...."
1) Quelle expérience peut on réaliser pour montrer que cette solution contient des ions ?
Une solution ionique ou électrolyte le courant électrique.
La conductance mesure la facilité avec laquelle le courant électrique traverse un conducteur.
Mesurer la conductance de la solution à l'aide d'un conductimètre. La conductance est d'autant plus que la solution contient plus d'ions.
2) Formule de l'ion potassium : 
3) En présence d'ion baryum, la solution S donne un précipité blanc; en déduire la nature de l'autre ion présent dans la solution.
L'ion baryum donne en présence d'ion  donne un solide blanc, le sulfate de baryum.
donne un solide blanc, le sulfate de baryum.
4) Quelle est la formule statistique du solide qu'il faut dissoudre dans l'eau pour obtenir la solution S ?
Le solide est électriquement neutre : donc ions potassium pour un ion sulfate.
5) A 20 mL de cette solution, on ajoute une solution de chlorure de baryum en excès. Le précipité obtenu est séché puis pesé. On obtient m= 0,327g. En déduire la concentration des ions qui donnent le précipité, la concentration de la solution et celle de l'autre ion.
Masse atomique molaire en g/mol : Ba :137 ; S : 32,0 ; O : 16,0.
Masse molaire du sulfate de baryum : M= 137+32+4*16 = g/mol.
Quantité de matière () du solide = masse (g) par la masse molaire (g/mol)
n(BaSO4)= 0,327 / 233 = 10 exposant -3 mol.
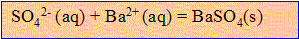
D'après les coefficients stoéchiométriques : n(ion baryum) = n(ion sulfate) = n(BaSO4)
La concentration (mol/L) de l'ion sulfate est égale à la quantité de matière (mol) divisée par le volume de la solution ()
[ion sulfate]=1,40 10^-3 / 20 10^-3 = 1,40/20 = 0,070 mol/L
La solution de sulfate de potassium est électriquement neutre.
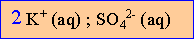 Donc [ion potassium]= fois [ion sulfate]= 0,14 mol/L
Donc [ion potassium]= fois [ion sulfate]= 0,14 mol/L
6) On dilue cette solution pour obtenir une solution S' de volume 250 mL dans laquelle la concentration en ions potassium est de 0,007 mol/L. Indiquer le mode opératoire.
Facteur de dilution = concentration mère (mol/L) / concentration fille (mol/L= 0,14 / 0,007 = .
volume de solution mère à prélever à la jaugée  : 250/20 = mL
: 250/20 = mL
Introduire dans une jaugée de 250 mL.
Compléter avec de l'eau distillée jusqu'au trait de jauge à l'aide d'une .
Agiter pour rendre homogène.