1) Déterminer la quantité de matière (mol) d'eau contenue dans un verre de volume 125 mL.
La masse volumique de l'eau est 1,00 kg / mètre cube.
2) Déterminer la quantité de matière (mol) d'eau contenue dans un glaçon de volume 10 centimètre cube.
La densité de la glace est : d= 0,927
3) Déterminer la quantité de matière (mol) d'eau contenue dans de la vapeur d'eau occupant un volume de 250 mL à la température de 110°C et à la pression de 1013 hPa. On considerera que la vapeur d'eau se comporte comme un gaz parfait. R = 8,31 SI.
Masse atomique molaire en g/mol : H=1 ; O=16.
La masse de 1 L d'eau est égale à 1 kg = g.
Un litre = 1000 mL ; 125 mL = L.
Masse d'eau contenue dans le verre : g.
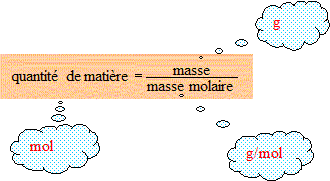
Masse molaire de l'eau : 16+2 = 18 g/mol
Quantité de matière d'eau dans le verre : 125 18 = mol.
densité de la glace d = 0,927 signifie : la masse de 1 L de glace est égale à g.
1 L= 1000 mL= 1000 centimètre cube.
10 centimètre cube = L
Masse du glaçon : 927*0,01 = g.
Quantité de matière d'eau dans le glaçon : 9,27 / 18 = mol.

V= 250 mL= 0,250 L = 2,5 10 exposant mètre cube.
P= 1013 hPa = 1,013 10 exposant Pa.
T= 273+110 = 383 .
n = PV / (RT) = 1,013 10^ 5 * 2,5 10^ -4 /(8,31*383)= 10 exposant -3 mole.