Une solution S d'acide éthanoïque 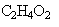 a une densité par rapport à l'eau d = 1,05. Le pourcentage massique en acide éthanoïque est égal à 90,0%.
a une densité par rapport à l'eau d = 1,05. Le pourcentage massique en acide éthanoïque est égal à 90,0%.
Masses atomiques molaires en g/mol : C : 12 ; H: 1 ; O: 16.
Calculer la concentration molaire C de l'acide éthanoïque dans cette solution.
La densité par rapport à l'eau d=1,05 signifie :
Un litre de la solution d'acide éthanoïque a une de 1,05 kg ou g.
La masse volumique de la solution acide vaut 1,05 g/mL ou 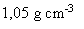
Le pourcentage massique en acide éthanoïque est égal à 90,0%. Cela signifie :
La masse d'acide éthanoïque pur, contenu dans un litre de solution est égal à fois la masse de la solution
soit : 0,9*1050 = 945 g.
Masse molaire de l'acide éthanoïque en g/mol : 2*12+4+2*16 = g/mol
Quantité de matière () d'acide dans la solution = masse () d'acide / masse molaire (g/mol)
n= /60=15,7 mol
concentration molaire ()= quantité de matière (mol) / volume de la solution ()
C= 15,7/1 = 15,7 mol/L