1) Calculer la masse d'une mole d'air dans les conditions normales de température et de pression ( CNTP ) si on considère que l'air est consitué en volume de 20% de dioxygène et de 80% d'azote. Masse molaire (g/mol) : N= 14 et O= 16.
2) On définit la densité d'un gaz par rapport à l'air comme le rapport de la masse d'un volume V de ce gaz à la masse d'un égal volume d'air pris dans les mêmes conditions de température et de pression. Si M est la masse molaire du gaz, montrer que sa densité peut être calculée par
d= M/29
3) Quel est ce gaz si la densité est d =0.068

masse molaire du diazote N2 : 14 +14 = 28 g/mol
Dans une mole d'air il y a mole de diazote
masse de diazote dans une mole d'air : Qté de matière ()* masse molaire (g/mol)
0,8*28 = 22,4 g.
masse molaire du dioxygène O2 : 16 +16 = 32 g/mol
Dans une mole d'air il y a mole de dioxygène
masse de dioxygène dans une mole d'air : Qté de matière (mol) * masse molaire (g/mol)
0,2*32 = 6,4 g
masse d'une mole d'air = des masses de ses constituants
Mair =22,4 + 6,4 = 28,8 g/mol.

La densité du gaz par rapport à l'air, est obtenue en divisant la masse d'un volume V de ce gaz par la masse d'un égal volume d'air pris dans les mêmes conditions de température et de pression.
En conséquence la densité est un nombre sans .
Je choisis un volume V égale au volume d'une mole. ( volume )
Si M est la masse molaire du gaz, Mair la masse molaire de l'air, d la densité du gaz :
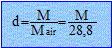
si d = 0,068 alors la masse molaire du gaz est M= 28,8*0,068=2 g
le gaz est le H2.