On réalise le mélange suivant :
* 250 mL de solution de chlorure de calcium 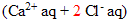 de concentration molaire en soluté apporté c1= 0,20 mol/L
de concentration molaire en soluté apporté c1= 0,20 mol/L
* 100 mL de solution de sulfate de calcium 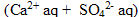 de concentration molaire en soluté apporté c2= 0,10 mol/L
de concentration molaire en soluté apporté c2= 0,10 mol/L
1) Quels sont les espèces présentes dans le mélange ?
2) Déterminer les concentrations de ces espèces.
3) Vérifier que la somme des charges négatives apportées par les anions est égale à la somme des charge positives apportées par les cations. Quelle est la signification de cette égalité ?

dans la solution 1 :
volume : 250 mL= L
concentration des ions calcium : 0,20 mol/L
quantité de matière des ions calcium : 0,20*0,25= mol.
concentration des ions chlorure : je multiplie la concentration molaire en soluté apportée par . 0,4 mol/L
quantité de matière en ion chlorure : 0,4*0,25 = mol
Dans la solution n°2 :
volume 100 mL= L
La concentration des ions calcium est à la concentration molaire en soluté apporté
quantité de matière en ion calcium : 0,1*0,1 = mol
La concentration en ion sulfate est à la concentration molaire en soluté apporté
quantité de matière en ion sulfate : 0,1*0,1 = mol
| ion calcium | ion chlorure | ion sulfate |
| solution 1 | 0,05 mol | 0,1 mol | dans le mélange |
| solution 2 | 0,01 mol | | 0,01 mol |
| dans le mélange | 0,06 mol | 0,1 mol | 0,01 mol |
volume du mélange : 250 +100 = 350 mL =
L

Dans le mélange :
concentration en ion calcium : 0,06
0,35 = 0,171 mol/L
concentration en ion chlorure : 0,1 / 0,35 = 0,286
.
concentration en ion sulfate : 0,01/0,35 = 0,029 mol/L
La solution est électriquement
:
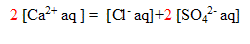
on vérifie :
pour l'ion positif : 2*0,171 = 0,34 mol/L
pour les ions négatifs : 0,286 + 2* 0,029 = 0,34 mol/L