Un airbag est constitué d’une enveloppe souple susceptible, lors d’un choc, de se remplir de diazote gazeux. Ce gaz provient de l’explosion de l’azoture de sodium,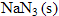 , déclenchée par un détonateur ; on obtient du sodium Na (s) et du diazote.
, déclenchée par un détonateur ; on obtient du sodium Na (s) et du diazote.
Après un choc, le volume de l’airbag vaut passe à V = 95 L, la pression du gaz dans l’enveloppe est p = 1200 hPa et sa température est : 35°C.
a) Ecrire l'équation bilan
b) Calculer la quantité de matière de diazote formé, le diazote étant assimilé à un gaz parfait.
c) Grâce à un tableau d’avancement, déterminer la masse d’azoture de sodium nécessaire au gonflage de l’airbag.
Données : Masse molaire (g/mol) Na = 23,0 , N = 14,0 , R = 8,31 S.I.



Qté de matière n = PV / (RT) avec :
P= 1200 hP = 1,2 10 exposant
Pa
V= 95 L = 9,5 exposant
mètre cube
T=
+35 = 308 K
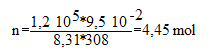

La réaction est terminée lorsque l'azoture de sodium est consommé : No -
Xmax=0 soit No= 2Xmax
De plus 3 Xmax =
mol soit Xmax = 1,48 mol
d'où No= 2*1,48 =
mol
Masse molaire azoture de sodium : 23 + 3 * 14 =
g/mol
masse (g) = masse molaire (g/mol) * Qté de matière (mol)
masse = 65*2,96 = 192 g.