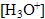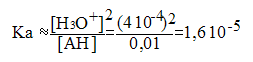On prépare une solution aqueuse d’acide carboxylique noté HA en dissolvant 1,80 g de cet acide pur dans de l’eau distillée. Le volume de solution obtenue est de 3 litres, et la concentration molaire apportée est de 0,01 mol / L. Le pH de cette solution est de 3,4.
masse atomique molaire (g/mol) : C : 12 ; H : 1 ; O : 16.
a) En solution aqueuse, cet acide est-il totalement dissocié en ions. Justifier.
b) Calculer la masse molaire de cet acide. Ce dernier peut-il être l'acide éthanoïque ?
c) Définir puis calculer la constante d'acidité Ka.

réaction de l'acide avec l'eau : 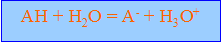
Dans le tableau d'évolution suivant, on raisonne sur 1 L de solution. Ce qui permet de confondre concentration (mol/L) et quantité de matière (mol)
l'acide est en défaut l'avancement maximal vaut : 0,01-Xmax=0 soit Xmax =
mol.
La valeur du pH donne la valeur de l'avancement
: Xfin =
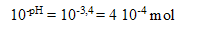
Le
d’avancement final de la réaction de l'acide dans l’eau est :
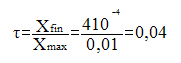
Le taux d'avancement final est inférieur à 1, la réaction entre l'acide et l’eau est
.

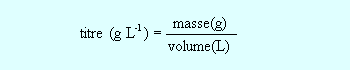
On dissout 1,8 g d'acide dans 3 litres de solution : le titre massique est(g/L) : 1,8 / 3 =
g par litre
massique ( g/L )=
molaire (mol/L) * masse molaire (g/mol)
masse molaire (g/mol) = titre massique ( g/L )/ concentration molaire (mol/L) = 0,6 / 0,01 =
g/mol
L’acide éthanoïque
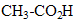
et HA ont même masse molaire.
De plus avec deux atomes de carbone , il ne correspond qu'un seul acide carboxylique : donc AH est l'acide éthanoïque ou acide
.

réaction de l'acide avec l'eau :
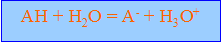
constante d'acidité :
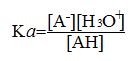
conservation de A :
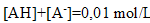
or l'acide est peu
donc [AH] voisin 0,01 mol/L
la solution est électriquement
:
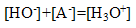
or en milieu acide
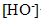
est
devant
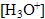
d'où :
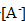
voisin