Un industriel produit du vinaigre par oxydation ménagée d’une solution aqueuse d’éthanol par le dioxygène de l’air, en milieu acide.
L’équation chimique modélisant la fabrication du vinaigre s’écrit :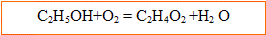
Les couple oxydant/réducteurs sont : 
1. Ecrire les demi équations électroniques correspondantes.
l'alcool éthylique s'oxyde et cède des électrons : réaction d'
.
le dioxygène se réduit est gagne des électrons : réaction de
.
2. Le vinaigre est obtenu a un titre égal à 6,0 °, soit une solution d’acide éthanoïque contenant 6,0 g d’acide éthanoïque pur pour 100 g de solution de densité d = 1,0. Masse molaire acide éthanoïque : 60 g/mol. Calculez la concentration molaire initiale en acide éthanoïque Co( concentration en soluté apporté).
Volume occupé par 100 g de vinaigre :masse (g) / densité = 100 mL=
L
Masse d'acide éthanoïque pur dans 1 L : 60 g.
Qté de matière(mol) d'acide dans 1L , donc concentration :
(g) / masse molaire (g/mol) : Co= 60/60 = 1 mol/L
3. Le pH de ce vinaigre est : pH = 2,4. Calculez les concentrations molaires de toutes les espèces présentes à l’état final.
| avancement (mol) | 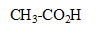 | +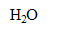 | =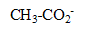 | +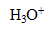 |
| initial | 0 | Co=1 | solvant | 0 | 0 |
| en cours | X | 1-X | en grande | X | X |
| fin | Xf | 1-Xf | quantité | Xf | Xf= 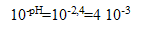 |
[
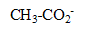
]=[
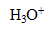
]=4
/L.
[
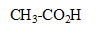
]= 1-0,004 =
mol/L.
4. L’industriel souhaite introduire un conservateur souvent utilisé dans l’alimentation : il ajoute 1,00 g de benzoate de sodium, de formule
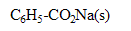
(M= 144g/mol) à 1,00 L du vinaigre précédent (sans modification de volume).
- Ecrivez l’équation de dissolution du benzoate de sodium solide dans l’eau.
- Déterminez la concentration molaire C’ apportée en ions benzoate dans le vinaigre.
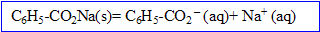
Qté de matière (mol) de benzoate de sodium = masse (g) / masse molaire (g/mol) = 1/144 =
mmol
C'= 6,94 mmol/L.
5.. En réalité, les ions benzoate réagissent avec l’acide éthanoïque. Cette transformation n’est pas totale.
- Donner les couples acide/base auxquels appartiennent l’acide éthanoïque et l’ion benzoate et écrivez l’équation de la réaction entre les ions benzoate et l’acide éthanoïque.
- Donner l’expression du quotient de réaction à l’équilibre et construire le tableau descriptif de l’évolution du système en utilisant l’avancement volumique X’V (on négligera la dissociation de l’acide éthanoïque dans l’eau).
couple acide base : acide éthanoïque
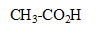
/ ion
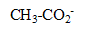
acide
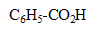
/ ion benzoate
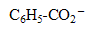
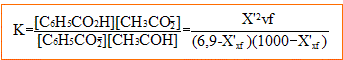
7. La constante d’équilibre de la réaction entre l’acide éthanoïque et les ions benzoate est K’ = 0,251 à 25°C.
- En résolvant une équation du second degré, calculer X’V,f.( noter simplement X dans l'équation)
- L’ajout du conservateur modifie-t-il notablement la concentration du vinaigre ? Justifier.
0,251(6,94-X)(1000-X)=X²
0,749X²+252,7 X -1742=0
La résolution donne X= 6,7 mmol/L.
La concentration du vinaigre passe de 1,0 mol/L à Co - X’v,f = 0,99 mol/L La concentration du vinaigre n’a pratiquement pas changée. La différence reste inférieure à l’incertitude de mesure.